Hjertesvigt
Hjertesvigt er et stort folkesundhedsproblem på verdensplan. Mens forekomsten af koronar hjertesygdom og akut myokardieinfarkt er blevet reduceret med ca. 50 % i løbet af de sidste par årtier, er forekomsten af hjertesvigt forblevet stabil. Nye data tyder på, at forekomsten af hjertesvigt blandt unge voksne er steget i de senere år (Nabel et al, Savarese et al). Det er en paradoksal og bekymrende tendens, især i lyset af forbedringerne i behandlingen af forhøjet blodtryk (koronar hjertesygdom og forhøjet blodtryk anses traditionelt for at være de vigtigste årsager til hjertesvigt). Det antages, at den aldrende befolkning og den øgede forekomst af fedme, diabetes og dysglykæmi driver hjertesvigtpandemien frem. Faktisk tyder en voksende mængde beviser på, at hjertesvigt nu er den hyppigste komplikation ved diabetes (Shah et al, McMurray et al).
Behandlingen af hjertesvigt udviklede sig hurtigt i 1970’erne og 1980’erne. Betablokkere, ACE-hæmmere (angiotensin-konverterende enzym) og angiotensin-receptorblokkere (ARB) blev introduceret og forbedrede overlevelsen dramatisk. Da pionererne Waagstein, Hjalmarsson og Swedberg foreslog at bruge betablokkere – som har negative inotrope og negative kronotrope effekter – til behandling af hjertesvigt, blev de mødt med skepsis. Deres skelsættende studier viste, at betablokkere forlænger livet, lindrer symptomer og reducerer risikoen for indlæggelse hos patienter med hjertesvigt. Flere skelsættende undersøgelser fulgte og viste, at betablokkere, ACE-hæmmere og ARB’er var effektive til behandling af hjertesvigt. De hurtige fremskridt i 1970’erne og 1980’erne blev efterfulgt af næsten to årtier uden noget større gennembrud i behandlingen af hjertesvigt. I 2014 introducerede PARADIGM-HF-studiet en ny lægemiddelklasse, ARNI (Angiotensin-Neprilysin Inhibitors), et længe ventet gennembrud.
Hjertesvigt er en alvorlig tilstand med en dårlig langtidsprognose. Den 5-årige overlevelsesrate efter indlæggelse for hjertesvigt er 60 %, hvilket kan sammenlignes med almindelige kræftformer (Stewart et al.). Derudover er hjertesvigt en invaliderende tilstand med en meget negativ indvirkning på livskvaliteten. Omkring halvdelen af alle patienter med hjertesvigt dør pludseligt som følge af ventrikulære arytmier (ventrikulærtakykardi, ventrikelflimren). Tidlig diagnose og aggressiv behandling kan forlænge overlevelsen, forbedre livskvaliteten, reducere hospitalsindlæggelser og mindske risikoen for pludselig død.
Ifølge American Heart Association (ACA) og European Society for Cardiology (ESC) findes der tre typer af hjertesvigt: HFPEF, HFmrEF og HFREF. Denne klassifikation er primært baseret på måling af venstre ventrikels ejektionsfraktion (LVEF). Størstedelen af alle kliniske forsøg, epidemiologiske studier og mekanistiske studier er blevet udført på HFREF (hjertesvigt med reduceret ejektionsfraktion). Derfor er vores nuværende viden om hjertesvigt stort set synonym med viden om HFREF. HFPEF (hjertesvigt med bevaret uddrivningsfraktion ) og HFmrEF (hjertesvigt med mellemstor uddrivningsfraktion ) er relativt nye enheder, og der findes i øjeblikket ingen effektive behandlinger, der ændrer det naturlige forløb ved disse tilstande. Alligevel er langtidsoverlevelsen lidt bedre blandt patienter med HFPEF sammenlignet med patienter med HFREF.
Tabel 1. Typer af hjertesvigt.
| Type | Beskrivelse | Ejektionsfraktion (%) |
|---|---|---|
| HFREF | Hjertesvigt med reduceret ejektionsfraktion | <40% |
| HFmrEF | Hjertesvigt med mellemstor uddrivningsfraktion | 40-49% |
| HFPEF | Hjertesvigt med bevaret uddrivningsfraktion | ≥50% |
Ved HEREF er venstre ventrikels systoliske funktion (ejektionsfraktion) nedsat (defineret som ejektionsfraktion <40%). Ved HFPEF er der kliniske tegn på hjertesvigt på trods af normal ejektionsfraktion (EF ≥50%). I HFMRef er der tegn på hjertesvigt med uddrivningsfraktion i området 40-49%.
De mekanismer, der forårsager HFPEF, er ukendte. Stort set alle patienter med HFPEF har diastolisk dysfunktion.
Størstedelen af alle patienter med hjertesvigt har omfattende komorbiditet. Iskæmisk hjertesygdom, myokardieinfarkt, hypertension, arytmier, lungesygdom, kronisk nyresygdom, diabetes (type 1-diabetes, type 2-diabetes) er almindelige sameksisterende tilstande. Dette komplicerer behandlingen af hjertesvigt på grund af risikoen for lægemiddelinteraktioner og komplicerer titreringen af medicin (f.eks. ACE-hæmmere hos patienter med nyresvigt). Kardiorenalt syndrom er en særlig dødelig kombination, hvor patienter har hjertesvigt og nyresvigt.
Epidemiologi af hjertesvigt
- Hjertesvigt er mere almindeligt blandt mænd.
- 6.5 millioner voksne i USA har hjertesvigt (Benjamin et al.)
- Hjertesvigt er en medvirkende årsag til 1 ud af 8 dødsfald i 2017 (CDC).
- Blandt personer på 65 år eller derover har 5-10 % hjertesvigt.
- Livstidsrisikoen for at udvikle hjertesvigt er 20 % for en 40-årig.
- Forekomsten af hjertesvigt har været stabil i de sidste to årtier på trods af dramatiske reduktioner i forekomsten af akutte myokardieinfarkter og forbedret behandling af forhøjet blodtryk.
- Diabetes er sandsynligvis en af de mest almindelige årsager til hjertesvigt (diabetisk kardiomyopati; Packer et al.).
Prognose
Tabel 2. Langtidsoverlevelse efter indlæggelse for hjertesvigt.
| Tid siden indlæggelse | Overlevelse (%) |
|---|---|
| 1 år | 70% |
| 5 år | 60% |
Dødeligheden ved hjertesvigt er den samme som ved almindelige kræftformer. Halvdelen af alle dødsfald skyldes pludseligt hjertestop på grund af ventrikulær takykardi og ventrikelflimmer. De resterende dødsfald skyldes en gradvis forværring af venstre ventrikels funktion og tromboemboliske komplikationer.
Årsager til hjertesvigt
Mekanismer for hjertesvigt
- Myokardiesygdom: patologisk ændring i myokardiet.
- Strukturel hjertesygdom: f.eks. hjerteklapsygdom, medfødt hjertesygdom.
- Arytmier
- Ledningsforstyrrelser
- Hæmodynamiske forhold
Den underliggende årsag afgør, om hjertesvigt er forbigående eller kronisk. For eksempel er hjertesvigt på grund af myokardieinfarkt kronisk, mens hjertesvigt på grund af takykardi (f.eks. atrieflimren) kan kureres med genoprettelse af sinusrytmen.
Relateret kapitel: Takykardi-induceret kardiomyopati.
Koronararteriesygdom og myokardieinfarkt
Myokardieinfarkt (STEMI, Non-STEMI) er den mest almindelige årsag til hjertesvigt. Med hensyn til koronar hjertesygdom diskuterer eksperter stadig, om kronisk iskæmi kan forårsage hjertesvigt i fravær af myokardieinfarkt (Camici et al, McMurray et al).
Forhøjet blodtryk
Forhøjet blodtryk er den mest almindelige årsag til sygelighed og dødelighed på verdensplan (Ezzati et al). Hypertension er også den næsthyppigste årsag til hjertesvigt. Forhøjet blodtryk forårsager hjertesvigt ved at øge efterbelastningen, som venstre hjertekammer modvirker ved at udvikle hypertrofi. Hypertrofi forårsager imidlertid hjertemodellering (se nedenfor), hvilket i sidste ende fører til nedsat systolisk funktion og kammerdilatation.
Sukkersyge
Diabetes er en almindelig årsag til hjertesvigt, og hjertesvigt betragtes som en diabeteskomplikation (diabetisk kardiomyopati; Packer et al.). Diabetisk kardiomyopati er formentlig forårsaget af kronisk hyperglykæmi, som inducerer mikrovaskulær dysfunktion og fremmer udviklingen af fibrose i myokardiet.
Arytmier, der forårsager hjertesvigt
Bradykardi (bradyarytmi) kan forårsage hjertesvigt, når hjertets minutvolumen (CO) falder til under behovet.
Langvarig takykardi (takyarytmi) kan forårsage hjertesvigt (takykardi-inducerethjertesvigt). En almindelig årsag til takykardi-induceret hjertesvigt er atrieflimren. Men enhver langvarig takyarytmi kan forårsage hjertesvigt.
Atrieflimren og hjertesvigt er stærkt korreleret. Det er dog uklart, om hjertesvigt forårsager atrieflimren, selvom det virker plausibelt; hjertesvigt fører til ventrikeldilatation og forhøjet ventrikel- og atrialtryk. Sidstnævnte kan efterfølgende føre til forstørrelse af venstre atrium og atrieflimren.
Strukturel hjertesygdom
Strukturel hjertesygdom refererer til strukturelle abnormiteter i myokardiet, klapper eller større kar. Myokardieinfarkt, som resulterer i strukturelle ændringer (nekrose) i myokardiet, betragtes også som en del af denne kategori. Andre tilstande omfatter medfødt hjertesygdom og hjerteklapsygdom (medfødt eller erhvervet). De mest almindelige hjerteklapsygdomme, der forårsager hjertesvigt, er som følger:
Perikardiesygdom (restriktiv perikarditis, konstriktiv perikarditis) kan også forårsage hjertesvigt ved at forringe ventrikulær afslapning (diastole).
Hjertets toksicitet
Misbrug af stoffer
Alkohol er det mest almindelige stof, der forårsager hjertesvigt. Alkoholisk kardiomyopati er en almindelig årsag til hjertesvigt på verdensplan. Alkohol forårsager dilateret kardiomyopati.
Kræftmedicin og strålebehandling
Kræftmedicin er en stadig mere almindelig årsag til hjertesvigt. De mest almindelige kræftlægemidler med kendt kardiotoksicitet er følgende (Suter et al):
- Doxorubicin
- Daunorubicin (daunomycin)
- Epirubicin
- Mitoxantron
- Fluorouracil (5-FU)
- Capecitabin
- Cyklofosfamid
- Cisplatin
- Paclitaxel
- Trastuzumab
- Lapatinib
- Bevacizumab
- Sunitinib
- Imatinib
- Dasatinib
- Nilotinib
Strålebehandling kan forårsage myokarditis og perikarditis (konstriktiv perikarditis), hvilket kan resultere i hjertesvigt.
Hjertetumorer og metastaser
Hjertetumorer kan forårsage hjertesvigt, og det samme kan hjertemetastaser.
Genetiske årsager til hjertesvigt
Ud over mutationer, der forårsager lagringssygdomme (se nedenfor), kan hjertesvigt skyldes genetiske mutationer, der påvirker hjertets myocytter. Disse mutationer forårsager typiske abnormiteter i strukturelle proteiner, især aktin, myosin og proteiner i desmosomet (intercalated discs). Sådanne mutationer fører til karakteristiske kardiomyopatier:
- Dilateret kardiomyopati (DCM)
- Hypertrofisk obstruktiv kardiomyopati (HOCM, HCM)
- Arytmogen højre ventrikel-kardiomyopati (ARVD, ARVC)
Andre årsager til hjertesvigt
- Tungmetaller – Ophobning af tungmetaller kan forårsage hjertesvigt. Følgende metaller er kendt for at forårsage hjertesvigt:
- Jern (hæmokromatose)
- Kobber
- Bly
- Kadmium
- Kobolt
- Opbevaringssygdomme
- Amyloidose
- Sarkoidose
- Pompes sygdom
- Fabrys sygdom
- Hæmokromatose (ophobning af jern)
- Immunologiske tilstande
- Reumatoid arthritis (RA)
- Systemisk lupus erythematosus (SLE)
- Kæmpecelle-myokarditis
- Eosinofil myokarditis
- Endokrine årsager
- Hypothyreose
- Hyperthyreose (tyreotoksikose)
- Hyperparathyreoidisme
- Cushings syndrom
- Akromegali
- Conn’s sygdom
- Addisons sygdom
- Graviditet
- Postpartum kardiomyopati (peripartum kardiomyopati) defineres som nyopstået hjertesvigt mellem den sidste måned af graviditeten og 5 måneder efter fødslen, forudsat at der ikke kan påvises andre årsager til hjertesvigt.
- Ernæringsmæssige årsager
- Anoreksi nervosa
- Mangel på tiamin (hjerteberiberi)
- Hæmodynamiske ændringer
- Hypotension
- Sepsis
- Alvorlig anæmi
- Volumenoverbelastning (f.eks. nyresvigt)
Remodellering af hjertet
Remodellering af hjertet ses hos de fleste patienter med hjertesvigt, uanset ætiologi. Hjertets remodellering påvirker det naturlige forløb af hjertesvigt. Det fører i sidste ende til gradvis dilatation (udvidelse) af venstre ventrikel og dermed forværring af hjertesvigt.
Hjertets remodellering er resultatet af ændringer i hjertemyocytternes genomiske udtryk. Disse ændringer resulterer i molekylære, cellulære og interstitielle ændringer, som gradvist påvirker hjertets størrelse, form og funktion. Celledød, interstitiel fibrose og nedsat kontraktilitet er kendetegnende for hjertemodellering.
Målet med hjertesvigtbehandling er at bremse eller vende udviklingen af hjertemodellering. ACE-hæmmere, ARB’er, ARNI og betablokkere påvirker alle remodelleringsprocessen.
Symptomer på hjertesvigt
Symptomerne på hjertesvigt er ofte uspecifikke, især i den tidlige fase. Det kan være en udfordring at skelne hjertesvigt fra andre almindelige kardiopulmonale tilstande, især hos følgende patienter:
- Patienter med lungesygdom (f.eks. kronisk obstruktiv lungesygdom [KOL]), da dyspnø og dårlig træningskapacitet er almindeligt ved kronisk lungesygdom.
- Overvægtige, fede eller diabetespatienter (type 2-diabetes): Disse patienter oplever ofte dyspnø og dårlig træningskapacitet på grund af kropsvægt og abdominal fedme.
- Ældre: Dyspnø og dårlig træningskapacitet er almindeligt hos ældre.
- Ankel- og underekstremitetsødem er almindelige bivirkninger af calciumkanalblokkere og glitazoner.
- Ankel- og underekstremitetsødem kan være forårsaget af venøs insufficiens.
Typiske symptomer på hjertesvigt
- Dyspnø (åndenød)
- Ortopnø (åndenød i liggende stilling)
- Paroxysmal natlig dyspnø (pludselige anfald af dyspnø om natten, typisk få timer efter at man er faldet i søvn)
- Dårlig træningskapacitet (træningsintolerance)
- Træthed
- Ankelødem, ødem i underekstremiteterne
Mindre typiske symptomer på hjertesvigt (uspecifikke)
- Hjertebanken
- Vægtøgning
- Vægttab (fremskreden hjertesvigt)
- Svimmelhed
- Synkope
- Hoste
- Tab af appetit
- Forvirring
- Depression
Vægtøgning på grund af væskeophobning er almindelig i den tidlige fase. Men ved fremskreden hjertesvigt er vægttab også almindeligt, hvilket kan forklares med udviklingen af kakeksi.
Symptomer på dekompenseret (akut) hjertesvigt
Hjertesvigt er en kronisk tilstand, der er kendetegnet ved en gradvis forringelse af hjertefunktionen. Klinisk stabile perioder kan afbrydes af pludselig forværring af hjertesvigt (dvs. dekompensation) med øget væskeophobning, forværret dyspnø og behov for hospitalsindlæggelse. Figur 1 viser typiske symptomer hos patienter med dekompenseret hjertesvigt (Goldberg et al.).
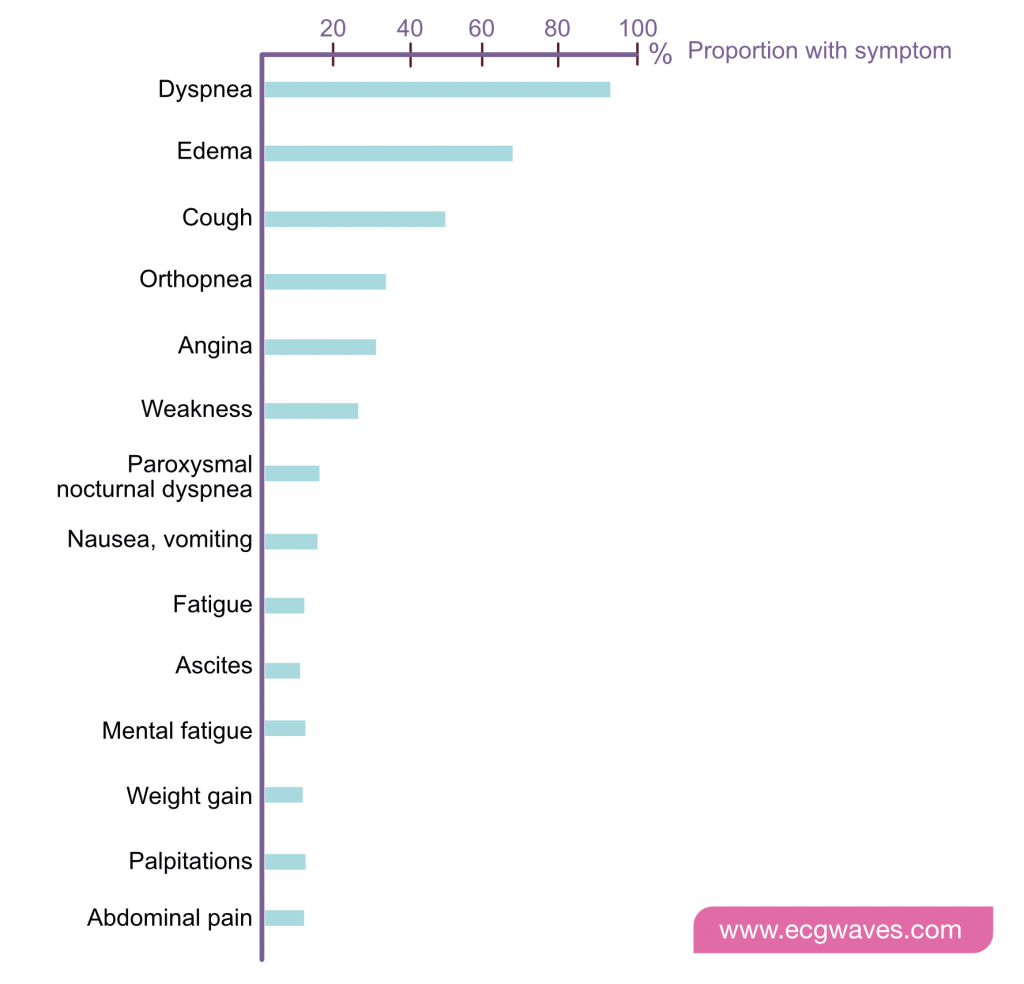
New York Heart Associations (NYHA) funktionelle klassifikation af hjertesvigt
Hjertesvigtpatienter klassificeres efter symptomernes sværhedsgrad. New York Heart Associations (NYHA) funktionelle klassifikation er det mest anvendte klassifikationssystem (tabel 3).
Tabel 3. New York Heart Associations (NYHA) funktionelle klassifikation af hjertesvigt
| NYHA-klasse | Patientens symptomer |
|---|---|
| I | Ingen begrænsning af fysisk aktivitet. Almindelig fysisk aktivitet forårsager ikke unødig træthed, hjertebanken eller dyspnø. |
| II | Let begrænsning af fysisk aktivitet. Behagelig i hvile. Almindelig fysisk aktivitet medfører træthed, hjertebanken, dyspnø. |
| III | Markant begrænsning af fysisk aktivitet. Behagelig i hvile. Mindre end almindelig aktivitet medfører træthed, hjertebanken eller dyspnø. |
| IV | Ude af stand til at udføre fysisk aktivitet uden ubehag. Symptomer på hjertesvigt i hvile. Hvis der udføres fysisk aktivitet, øges ubehaget. |
Kliniske tegn på hjertesvigt
Fysisk undersøgelse kan afsløre noget af det følgende hos patienter med hjertesvigt:
- Hepatojugulær refluks: Når patienten sidder i en vinkel på 45°, fører tryk på leveren til udvidelse af halsvenen. Halsvenen er udspilet, fordi blodgennemstrømningen gennem højre ventrikel er nedsat hos patienter med hjertesvigt.
- Bred v. jugularis på grund af udspiling af venen (øget venetrykiv. jugularis). Dette tyder på højre hjertesvigt.
- Tilstedeværelse af en tredje hjertelyd (S3), også kendt som “ventrikulær galop”.
- Lateral forskydning og forstørrelse af den apikale (spids) impuls.
- Pulmonal auskultation: Fine eller grove knitrelyde, afhængigt af sværhedsgraden af lungeødem.
- Pulmonal perkussion: kedelig perkussionsnote.
- Takykardi: Hjertets output opretholdes ved at øge hjertefrekvensen.
- Uregelmæssig puls: ekstrasystoler (supraventrikulær ekstrasystole, ventrikulær ekstrasystole) og supraventrikulære arytmier (atrieflimren, atrieflagren, atrialtakykardi osv.) er almindelige ved hjertesvigt. Ventrikulære arytmier (ventrikulærtakykardi) er mindre almindelige, men forekommer hos de fleste patienter med hjertesvigt.
- Takypnø
- Hepatomegali
- Ascites
- Kolde ekstremiteter
- Oliguri
- Smalt pulstryk
Diagnosticering af hjertesvigt: kriterier og retningslinjer
Diagnosticering af kronisk hjertesvigt
Patienter med symptomer eller tegn på hjertesvigt kan udredes i primærsektoren eller på et ambulatorium. Den indledende evaluering skal afgøre sandsynligheden for hjertesvigt ved at vurdere følgende komponenter:
- Medicinsk anamnese
- Fysisk undersøgelse
- 12-afledningers hvile-EKG
En detaljeret sygehistorie er grundlæggende for at vurdere risikoen for hjertesvigt. Tilstedeværelsen af koronararteriesygdom, tidligere myokardieinfarkt, hypertension og andre risikofaktorer og årsager til hjertesvigt bør gennemgås nøje. Den fysiske undersøgelse skal fokusere på de tegn, der er nævnt ovenfor. Alle patienter skal have taget et hvile-EKG.
Figur 2. Evaluering af patienter med symptomer eller tegn på hjertesvigt.
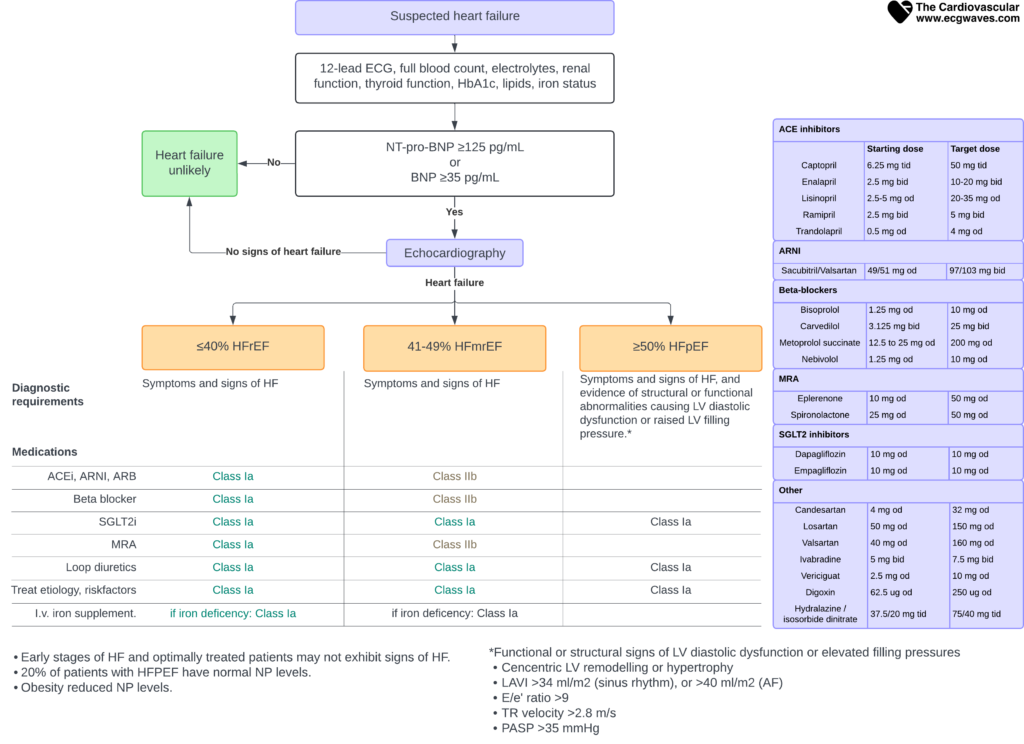
Hvis sygehistorie, fysisk undersøgelse og EKG alle er normale, er hjertesvigt usandsynligt, og andre diagnoser bør overvejes. Hvis nogen af komponenterne er unormale, skal de natriuretiske peptider i plasma måles. Den øvre normale grænse for natriuretiske peptider (NT-proBNP og BNP) er tærsklen for at udelukke hjertesvigt.
NT-proBNP og BNP ved hjertesvigt
Natriuretiske peptider i plasma vurderes hos patienter med unormal sygehistorie, fysisk undersøgelse eller hvile-EKG. American Heart Association og European Society for Cardiology anbefaler måling af BNP (Brain Natriuretic Peptide) eller NT-proBNP (N-Terminal proBNP). Hvis NT-proBNP eller BNP er højere end tærskelværdien (for at udelukke hjertesvigt), bør der udføres ekkokardiografi. Ekkokardiografi bør også udføres, hvis NT-proBNP og BNP ikke er tilgængelige.
NT-proBNP- eller BNP-niveauer over grænseværdien tyder stærkt på hjertesvigt og kræver yderligere undersøgelse med ekkokardiografi.
Tabel 4. Tærskelværdier for NT-proBNP og BNP
| Biomarkør | Tærskelværdi for udelukkelse af hjertesvigt |
|---|---|
| Kronisk hjertesvigt | |
| NT-proBNP | 125 pg/mL |
| BNP | 35 pg/mL |
| Akut (dekompenseret) hjertesvigt | |
| NT-proBNP | 300 pg/mL |
| BNP | 100 pg/mL |
Høje niveauer af NT-proBNP eller BNP tyder stærkt på hjertesvigt. Der er dog mange andre årsager til forhøjede niveauer af natriuretiske peptider (Tabel 5). Værdien af at måle NT-proBNP og BNP er størst, når sandsynligheden for hjertesvigt er lav til moderat. Bemærk, at tærsklen for natriuretiske peptider er højere i den akutte situation (Tabel 5). De samme tærskler gælder for HFREF og HFPEF. Generelt har patienter med HFREF højere niveauer af NT-proBNP og BNP.
I henhold til de nuværende (2024) retningslinjer fra ESC, AHA og ACC udelukkes hjertesvigt, hvis NT-proBNP- eller BNP-niveauerne er under tærsklen.
Bemærk, at fedme resulterer i lavere niveauer af NT-proBNP og BNP. Desuden kan patienter med hjertesvigt, som er velbehandlede, udvise normale eller næsten normale niveauer af natriuretiske peptider.
Tabel 5. Årsager til forhøjede niveauer af natriuretiske peptider (NT-proBNP, BNP)
| KARDIALE ÅRSAGER |
| Hjertesvigt |
| Atrieflimren |
| Akutte koronare syndromer |
| Lungeemboli |
| Venstre ventrikelhypertrofi (LVH) |
| Hypertrofisk kardiomyopati (HCM, HOCM) |
| Myokarditis, perimyokarditis |
| Elektrisk konvertering, defibrillering |
| Medfødt hjertesygdom |
| Hjerteoperation |
| Pulmonal hypertension |
| Takyarytmier |
| IKKE-HJERTEKRÆVENDE ÅRSAGER |
| Nyresvigt |
| Aldring |
| Slagtilfælde |
| Subaraknoidal blødning |
| Levercirrhose |
| KOL (kronisk obstruktiv lungesygdom) |
| Anæmi |
| Alvorlig infektion (sepsis, lungebetændelse) |
| Ketoacidose |
| Thyreotoksikose |
| Paraneoplastisk syndrom |
EKG ved hjertesvigt
Et helt normalt EKG taler kraftigt imod hjertesvigt (Mant et al.). Det er ofte svært at afgøre, om EKG’et er helt normalt. Der er mange normale varianter og ikke-signifikante abnormiteter, som kan være tvetydige.
EKG’et kan hverken bekræfte eller udelukke hjertesvigt, men et helt normalt EKG taler stærkt imod hjertesvigt.
Ekkokardiografi ved hjertesvigt
Ekkokardiografi er den foretrukne metode til at undersøge hjertets funktion. Traditionelt har ejektionsfraktion (EF) været den dominerende parameter til vurdering af hjertefunktionen. I dag undersøges diastolisk funktion, systolisk ventrikelfunktion, ventrikelstørrelse, atriestørrelser osv. med mange forskellige metoder. Selvom diagnosen HFREF udelukkende er baseret på ejektionsfraktion, er det nødvendigt med flere andre parametre for kammerstørrelse og diastolisk funktion for at kunne stille diagnosen HFPEF (hjertesvigt med bevaret ejektionsfraktion).
Ekkokardiografi kan bestemme typen af hjertesvigt (HFREF, HFPEF, HFmrEF) og vurdere strukturelle og funktionelle parametre med hensyn til myokardiet, klapper, perikardium og kammerdimensioner.
Hjertemagnetisk resonansbilleddannelse (MRI)
Hjerte-MR anses for at være guldstandarden for de fleste parametre for hjertefunktion. Selvom brugen af hjerte-MR er stigende, er den stadig ikke bredt tilgængelig og anbefales derfor ikke som en del af den rutinemæssige evaluering af patienter med mistanke om hjertesvigt.
Diagnostiske kriterier for hjertesvigt
Hjertesvigt med reduceret uddrivningsfraktion (HFREF)
Kriterier for hjertesvigt med reduceret ejektionsfraktion (HFREF):
- Symptomer på hjertesvigt, med eller uden objektive tegn på hjertesvigt.
- Ejektionsfraktion <40 %.
Hjertesvigt med mellemstor uddrivningsfraktion (HFmrEF)
Kriterier for HFmrEF:
- Symptomer på hjertesvigt, med eller uden objektive tegn på hjertesvigt.
- Ejektionsfraktion 40-49%
- Forhøjede niveauer af NT-proBNP eller BNP.
- En eller to af følgende:
- Strukturel hjertesygdom (venstre ventrikelhypertrofi og/eller forstørret venstre atrium)
- Diastolisk dysfunktion
Hjertesvigt med bevaret uddrivningsfraktion (HFPEF)
Det er relativt vanskeligt at diagnosticere hjertesvigt med bevaret ejektionsfraktion. Det skyldes dels, at der ikke er nogen klar konsensus om, hvordan den diastoliske funktion skal bestemmes. Der findes en række ekkokardiografiske teknikker til at vurdere diastolisk dysfunktion. Langt de fleste patienter med HFPEF udviser strukturelle abnormiteter, især venstre ventrikelhypertrofi (LVH) eller forstørrelse af venstre atrium (LAE).
- Det er vanskeligt at stille diagnosen HFPEF.
- Symptomerne er mindre udtalte hos patienter med HFPEF sammenlignet med patienter med HFREF.
- HFPEF er mere almindelig blandt kvinder, ældre, diabetikere, personer med søvnapnø, fedme, overvægt, KOL, pulmonal hypertension, metabolisk syndrom, atrieflimren, forhøjet blodtryk og kronisk nyresygdom.
Kriterier for hjertesvigt med bevaret ejektionsfraktion (HEFPEF):
- Symptomer på hjertesvigt, med eller uden objektive tegn på hjertesvigt.
- Ejektionsfraktion ≥50% (normal) *
- Forhøjede niveauer af NT-proBNP eller BNP.
- En eller to af følgende:
- Strukturelle abnormiteter (LVH og/eller LAE)
- Diastolisk dysfunktion
*I nogle kliniske studier er cut-off for ejektionsfraktion ≥40%, hvilket er klassificeret som HFmrEF ifølge ESC.
Strukturelle ændringer i overensstemmelse med hjertesvigt ifølge ESC:
- Volumenindeks for venstre atrium (LAVI) >34 ml/m²
- Venstre ventrikels masseindeks (LVMI) ≥ 115 g/m² for mænd og ≥ 95 g/m² for kvinder.
- E/E′ ≥13
- Gennemsnitlig e’ septal og lateral væg <9 cm/s.
Behandling af hjertesvigt
Mål for behandlingen
Den ideelle behandling af hjertesvigt bør have en gavnlig effekt på alle fire følgende elementer:
- Lindre symptomer, reducere lidelse og øge livskvaliteten.
- Reducere antallet af hospitalsindlæggelser.
- Forbedre den funktionelle kapacitet.
- Forlænge overlevelsen.
Generelt vil behandlinger, der forlænger overlevelsen (f.eks. betablokkere), også lindre symptomer, reducere risikoen for hospitalsindlæggelse og forbedre funktionsevnen. Diuretika har på den anden side en markant effekt på symptomer, men ingen effekt på overlevelse.
Den nuværende evidensbaserede behandling af hjertesvigt er næsten udelukkende baseret på patienter med HFREF. Der er ingen evidensbaseret behandling til rådighed for HFPEF.
Behandling af hjertesvigt med nedsat ejektionsfraktion (HFREF)

Diuretika
- Alle patienter med hjertesvigt har brug for diuretika for at lindre dyspnø og fjerne overskydende væske.
- Det anbefales at bruge den lavest mulige dosis for at undgå hypokaliæmi og hyponatriæmi. Højere doser er nødvendige ved fremskreden hjertesvigt.
- Overvej den øgede risiko for gigtartritis.
Tabel 6. Diuretika
| Begyndelsesdosis (mg) | Regelmæssig daglig dosis (mg) | |
|---|---|---|
| LOOP DIURETICS | ||
| Furosemid | 20-40 | 40-240 |
| Bumetanid | 0.5-1.0 | 1-5 |
| Torasemid | 5-10 | 10-20 |
| TIAZIDER | ||
| Hydrochlorthiazid | 25 | 12.5-100 |
| Metolazon | 2.5 | 2.5-10 |
| lndapamidec | 2.5 | 2.5-5 |
Tabel 7. Kaliumbesparende diuretika
| Begyndelsesdosis ved brug af ACEi/ARB (mg) | Begyndelsesdosis, hvis du ikke bruger ACEi/ARB (mg) | Regelmæssig dosis ved brug af ACEi/ARB (mg) | Regelmæssig dosis, hvis du ikke bruger ACEi/ARB (mg) | |
|---|---|---|---|---|
| Spironolakton, eplerenon | 12.5-25 | 50 | 50 | 100- 200 |
| Amilorid | 2.5 | 5 | 5-10 | 10-20 |
| Triamteren | 25 | 50 | 100 | 200 |
ACEi = ACE-hæmmer; ARB = angiotensin II-receptorantagonist.
ACE-hæmmere (ACEi)
- ACE-hæmmere har gavnlige virkninger på alle behandlingsmål, herunder forlængelse af overlevelsen, og bør derfor overvejes til alle patienter med hjertesvigt.
- ACE-hæmmere reducerer produktionen af angiotensin II, som har flere skadelige virkninger hos patienter med hjertesvigt.
- ACE-hæmmere forårsager en tør, vedvarende hoste hos 10-30 % af patienterne. Overvej at skifte til ARB’er, hvis hosten er uudholdelig.
- Andre almindelige bivirkninger er hypotension og nyresvigt. Elektrolytter bør vurderes hos patienter, der er modtagelige for elektrolytforstyrrelser.
- ACE-hæmmere bør anvendes med forsigtighed til patienter, der tager NSAID (ikke-steroide antiinflammatoriske lægemidler).
Tabel 8. ACE-hæmmere
| Begyndelsesdosis (mg) | Måldosis (mg) | |
|---|---|---|
| Captopril | 6.25 × 3 | 50 × 3 |
| Enalapril | 2.5 × 2 | 10-20 × 2 |
| Lisinopril | 2.5-5.0 × 1 | 20-35 × 1 |
| Ramipril | 2.5 × 1 | 10 × 1 |
| Trandolapril | 0.5 × 1 | 4 × 1 |
Betablokkere
- Alle patienter bør have betablokkere, som har en positiv effekt på alle behandlingsmål ved hjertesvigt. Betablokkere reducerer dødeligheden med 33 %.
- Betablokkere reducerer de skadelige virkninger af noradrenalin og adrenalin i myokardiet.
- Start lavt, gå langsomt frem og titrer til den maksimalt tolererede dosis.
- En midlertidig forværring af hjertefunktionen kan forekomme, men er forbigående, og venstre ventrikels funktion forbedres gradvist; en midlertidig dosisreduktion kan tilrådes, hvis det er nødvendigt.
Tabel 9. Betablokkere
| Betablokker | Indledende dosis (mg) | Måldosis (mg) |
|---|---|---|
| Bisoprolol | 1.25 × 1 | 10 × 1 |
| Carvedilol | 3.125 × 2. | 25 × 2 d |
| Metoprololsuccinat | 12.5-25 × 1 | 200 × 1 |
| Nebivolol | 1.25 × 1 | 10 × 1 |
Angiotensin II-receptorblokkere (ARB’er)
- Effekter svarende til ACE-hæmmere. Forlænger overlevelsen. Nogle data tyder på, at ARB’er er lidt mere effektive end ACE-hæmmere (McMurray et al.).
- ARB’er forhindrer angiotensin II i at binde sig til sin receptor og afbryder dermed RAAS-aksen.
- ARB’er forårsager ikke hoste og foretrækkes hos patienter, der er generet af hoste fremkaldt af ACE-hæmmere.
- ARB kan tilføjes til ACE-hæmmere, hvilket reducerer dødeligheden yderligere (McMurray et al.). Kombination af ARB og ACE-hæmmere kræver dog gentagne kontroller af nyrefunktion og elektrolytter.
| ARB’er | Indledende dosis (mg) | Måldosis (mg) |
|---|---|---|
| Candesartan | 4-8 × 1 | 32 × 1 |
| Valsartan | 40 × 2 | 160 × 2 |
| Losartan | 50 × 1 | 150 × 1 |
Aldosteron-antagonister (MRA)
- Aldosteron er en del af RAAS-systemet. Blokering af aldosterons effekt resulterer i hæmning af den skadelige RAAS-akse.
- Spironolacton og eplerenon reducerer dødeligheden ved hjertesvigt.
- Kliniske studier er blevet udført på patienter med NYHA-klasse II, III og IV. Effekten af aldosteronantagonisme er ukendt ved hjertesvigt med NYHA-klasse I.
- Spironolacton og eplerenon anbefales, hvis ACE/ARB og betablokkere er utilstrækkelige.
- Spironolacton og eplerenon kan forårsage hyperkaliæmi og nedsat nyrefunktion.
- Spironolacton kan forårsage gynækomasti hos mænd.
| Indledende dosis (mg) | Måldosis (mg) | |
|---|---|---|
| Eplerenon | 25 × 1 | 50 × 1 |
| Spironolakton | 25 × 1 | 50 × 1 |
ARNI (Sacubitril-valsartan)
Sacubitril-valsartan er det eneste stof i lægemiddelklassen ARNI (Angiotensin Receptor Neprilysin Inhibitor). Sacubitril-valsartan er et kombinationslægemiddel, der består af en ARB (valsartan) og sacubitril, som hæmmer neprilysin og dermed blokerer nedbrydningen af natriuretiske peptider. Brugen af ARNI resulterer i øgede niveauer af natriuretiske peptider. Sacubitril-valsartan reducerer morbiditet og mortalitet ved hjertesvigt (NYHA II, III og IV).
ARNI anbefales til patienter med:
- Hjertesvigtmedreduceret ejektionsfraktion (HFrEF), hvis patienten fortsat er symptomatisk på trods af tilstrækkelige doser ACEi/ARB.
- Hjertesvigt med nedsat ejektionsfraktion (HFrEF), hvis patienten ikke kan tåle ACE-hæmmere og ARB.
Udvaskningsperiode for ACE-hæmmere og ARB’er
Når man skifter fra en ACE-hæmmer til en ARNI, anbefales en 36-timers udvaskningsperiode mellem den sidste dosis ACE-hæmmer og den første dosis ARNI for at reducere risikoen for angioødem. Den samme 36-timers udvaskningsperiode gælder, når man skifter fra en ARNI tilbage til en ACE-hæmmer. En udvaskningsperiode er dog ikke nødvendig, når der skiftes fra en angiotensin II-receptorblokker (ARB) til en ARNI. Det anbefales at indlede behandlingen med ARNI med en lav dosis (24/26 mg to gange dagligt) og optrappe hver 2.-4. uge, hvis det tolereres, med henblik på en måldosis på 97/103 mg to gange dagligt. For patienter med nedsat nyrefunktion eller bekymring for hypotension kan en mere konservativ optitrering overvejes.
| Angiotensin-receptor neprilysin-hæmmere (ARNI) | Indledende dosis (mg) | Måldosis (mg) |
|---|---|---|
| Sacubitril/valsartan (Entresto) | 49/51 × 2 | 97/103 × 2 |
Ivabradin
Ivabradin hæmmer selektivt HCN-kanalerne, almindeligvis kendt som “funny channels” (If), i sinoatrialknuden. Denne hæmning mindsker den intrinsiske pacemakeraktivitet, hvilket fører til en reduktion af hjertefrekvensen. Ivabradin er indiceret til patienter med stabil kronisk hjertesvigt i NYHA-klasse II til IV med nedsat ejektionsfraktion (35 % eller mindre), som er i sinusrytme med en hjertefrekvens på 75 slag i minuttet eller derover. Det anvendes i kombination med standardbehandling, herunder betablokkere, eller når behandling med betablokkere er kontraindiceret eller ikke tolereres. Ved at sænke hjertefrekvensen reducerer ivabradin myokardiets iltbehov og forbedrer træningskapaciteten.
| Hvis kanalblokkere | Indledende dosis (mg) | Måldosis (mg) |
|---|---|---|
| Ivabradin | 5 × 2 | 7.5 × 2 |
Digoxin (digitalis)
- Digoxin (digitalis) har en positiv inotrop effekt og øger dermed myokardiets iltforbrug. Digoxins rolle ved hjertesvigt er blevet draget i tvivl i de senere år.
- digoxin kan overvejes til patienter med atrieflimren og ventrikelfrekvens >70 slag pr. minut.
Behandling af hjertesvigt med bevaret ejektionsfraktion (HFPEF)
- Diuretika, ACE-hæmmere, ARB’er, aldosteronantagonister, betablokkere, ARNI, ivabradin og digoxin påvirker ikke overlevelsen ved HFPEF.
- Nuværende evidensbaseret behandling foreslår at fokusere på komorbiditet og risikofaktorer.
- Konventionel hjertesvigtmedicin kan bruges på individuel basis, men en generel anbefaling mangler videnskabelig evidens.
Andre behandlinger for hjertesvigt
- Rygestop og vægttab.
- Vaccinationer: pneumokokker, influenza, COVID-19 (SARS-COV-2), når de er tilgængelige.
- Undgå antiarytmika (amiodaron kan bruges ved atrieflimren), antipsykotika, kortikosteroider og NSAID’er.
- Begrænsning af saltforbruget er almindeligt, selvom den videnskabelige støtte er begrænset.
- Et moderat indtag af alkohol er sandsynligvis ikke skadeligt.
- Tilskynd til fysisk aktivitet.
Apparatbehandling af hjertesvigt
Hjertets resynkroniseringsterapi (CRT)
- ICD reducerer dødeligheden med 23 % hos HFREF.
- CRT reducerer dødeligheden med 20 %.
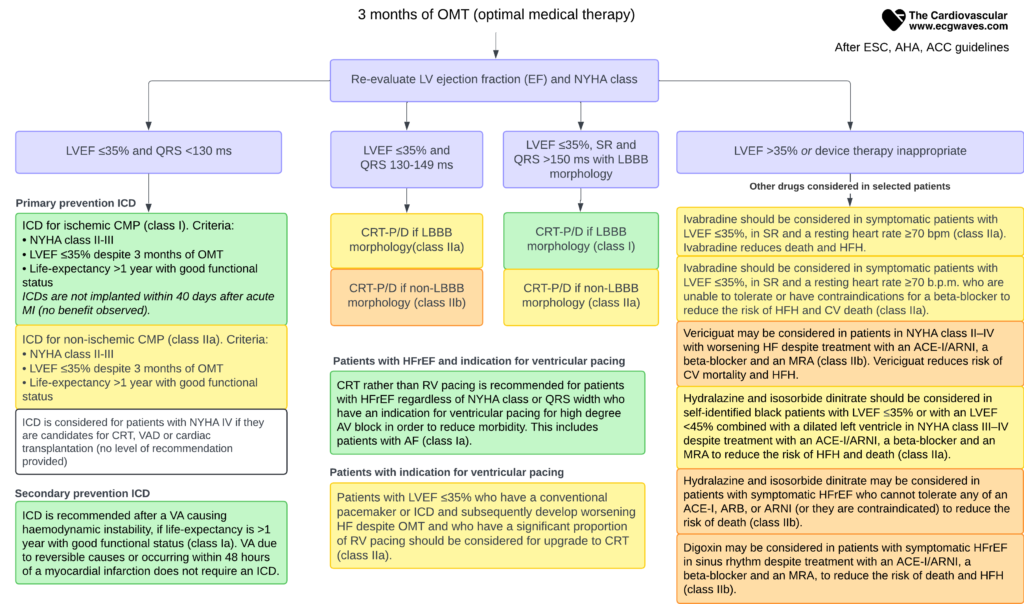
Formålet med CRT (kardial resynkroniseringsterapi) er at opnå resynkronisering af højre og venstre ventrikels depolarisering (dvs. aktivering, sammentrækning). Ca. 25 % af hjertesvigtspatienterne udviser ventrikulær dyssynkroni, hvilket betyder, at aktiviteten i venstre og højre ventrikel ikke er synkroniseret, hvilket resulterer i ineffektive sammentrækninger. Kendetegnende for dyssynkroni er det brede QRS-kompleks på EKG (QRS-varighed >120 ms). CRT giver mulighed for betydelig resynkronisering af ventrikulær aktivering. For at CRT skal være effektiv, skal QRS-varigheden være betydeligt forlænget. Derfor svarer en smallere QRS-varighed til en svagere indikation for CRT. Indikationerne for CRT hos patienter med hjertesvigt er vist i figur 4.
Patienter med LVEF ≤35% og QRS 130-149 ms:
- Hvis LBBB-morfologi: CRT-P/D anbefales (klasse IIa).
- Hvis ikke-LBBB-morfologi: CRT-P/D kan overvejes (klasse IIb).
Patienter med LVEF ≤35%, sinusrytme og QRS ≥150 ms med LBBB-morfologi
- CRT-P/D anbefales på det kraftigste (klasse I).
- CRT-P/D kan overvejes ved ikke-LBBB-morfologi (klasse IIa).
Patienter med HFrEF og enhver anden indikation for ventrikulær pacing
- CRT frem for konventionel RV-pacing anbefales til patienter med HFrEF uanset NYHA-klasse eller QRS-bredde, når ventrikulær pacing er indiceret for højgradig AV-blok for at reducere morbiditeten (klasse I). Dette omfatter patienter med atrieflimren (AF).
Patienter med indikation for ventrikulær pacing
- Patienter med LVEF ≤35 %, med en konventionel pacemaker eller ICD og forværring af hjertesvigt på trods af optimal medicinsk behandling (OMT) bør overvejes opgraderet til CRT, hvis der er en betydelig andel af RV-pacing til stede (klasse IIa).
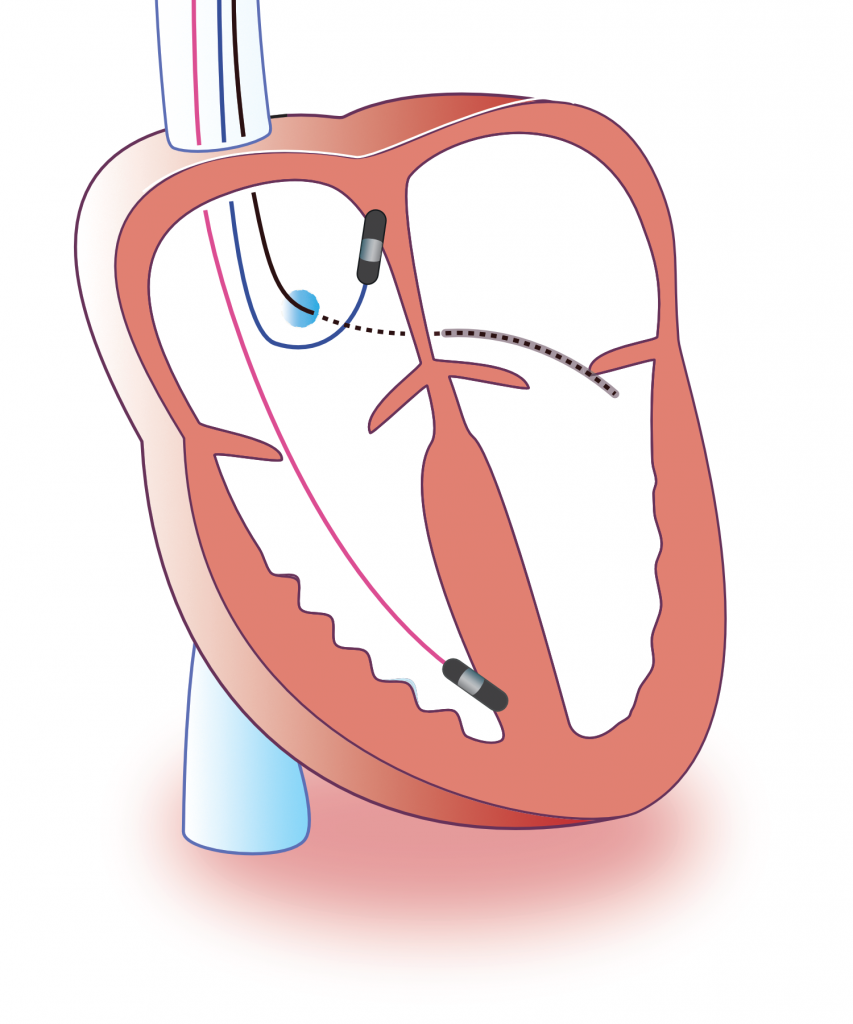
Implanterbar kardioverter-defibrillator (ICD)
En implanterbar cardioverter-defibrillator (ICD) overvåger kontinuerligt hjerterytmen og afgiver elektrisk stød eller anti-takykardi-pacing (ATP) for at afslutte ventrikulære arytmier, baseret på en patientspecifik detektions- og behandlingsprotokol. ICD-behandling er yderst effektiv til at reducere dødeligheden blandt passende udvalgte patienter med risiko for pludselig hjertedød. Kliniske forsøg har vist betydelige overlevelsesfordele i disse populationer:
- SCD-HeFT-forsøget rapporterede en 23 % reduktion i dødelighed af alle årsager for hjertesvigtspatienter med ICD’er sammenlignet med placebo over fem år (Bardy et al.).
- MADIT-II-forsøget viste forbedret overlevelse hos post-myokardieinfarktpatienter med nedsat venstre ventrikelfunktion, der fik ICD-behandling (Moss et al.)
ICD’er er vigtige enheder til forebyggelse af pludselig hjertedød hos personer med høj risiko for alvorlige hjertearytmier.
Indikationer for ICD-implantation
ICD’er er indiceret til både primær og sekundær forebyggelse af pludselig hjertedød (SCD).
Primær forebyggelse med ICD
- En ICD anbefales (klasse I) til patienter med iskæmisk kardiomyopati, som opfylder følgende kriterier:
- NYHA klasse II-III
- LVEF ≤35% på trods af 3 måneders OMT
- Forventet levetid >1 år med god funktionel status.
- En ICD anbefales (klasse IIa) til patienter med ikke-iskæmisk kardiomyopati, der opfylder følgende kriterier:
- NYHA klasse II-III
- LVEF ≤35% på trods af 3 måneders OMT
- Forventet levetid >1 år med god funktionel status
- ICD overvejes til patienter med NYHA IV, hvis de er kandidater til CRT, VAD eller hjertetransplantation (der er ikke angivet noget anbefalingsniveau)
ICD’er implanteres ikke inden for 40 dage efter akut myokardieinfarkt, da der ikke er observeret nogen fordel i denne patientpopulation (Steinbeck et al.). ICD-behandling anses for nytteløs og potentielt skadelig hos patienter med en forventet levetid på mindre end et år og er derfor kontraindiceret.
Sekundær forebyggelse med ICD
En ICD anbefales efter en ventrikulær arytmi, der forårsager hæmodynamisk ustabilitet, hvis den forventede levetid er >1 år med god funktionel status (klasse Ia anbefaling). Ventrikulær arytmi, der skyldes reversible årsager, eller som opstår inden for 48 timer efter et myokardieinfarkt, kræver ikke en ICD.
Effekt af implanterbare cardioverter-defibrillatorer
Ved ikke-iskæmisk hjertesvigt viste en metaanalyse af fem randomiserede forsøg med 2.573 patienter, at ICD-behandling var forbundet med en signifikant lavere risiko for dødelighed af alle årsager (relativ risiko: 0,83; 95 % CI: 0,71 til 0,97) sammenlignet med medicinsk behandling alene (Theuns et al.). Ved iskæmisk hjertesygdom har metaanalyser vist en 29 % relativ risikoreduktion i dødelighed af alle årsager med ICD-implantation (Yehya et al.). ICD’er er meget effektive og afslutter med succes over 99 % af alle ventrikulære arytmier (Tran et al.). Der er stærk evidens for brugen af ICD’er i højrisikogrupper til både primær og sekundær forebyggelse af pludselig hjertedød. Effektiviteten af ICD’er varierer dog afhængigt af den underliggende hjertesygdom og individuelle patientfaktorer. Følgende kan udledes af randomiserede kliniske forsøg:
- Patienter, der allerede har oplevet livstruende arytmier eller overlevet et hjertestop, viser den mest konsekvente fordel ved ICD-implantation.
- Personer med hjertesvigt på grund af iskæmisk hjertesygdom, især dem med et tidligere myokardieinfarkt, viser den største dødelighedsreduktion med ICD-behandling sammenlignet med ikke-iskæmiske kardiomyopatier. Selvom ICD’er reducerer pludselig hjertedød hos patienter med ikke-iskæmisk kardiomyopati, viste DANISH-studiet ingen signifikant effekt på dødeligheden af alle årsager (Køber et al.).
- Patienter med venstre ventrikels uddrivningsfraktion (LVEF) tættere på 25 % har tendens til at have større gavn af ICD’en end dem med LVEF tættere på 35 % (Tran et al., Brignole et al.).
- Patienter uden yderligere risikofaktorer ud over reduceret ejektionsfraktion har muligvis ikke nogen væsentlig fordel af ICD-implantation (Brignole et al.).
- Patienter med fremskreden hjertesvigt (NYHA-klasse IV) eller flere komorbiditeter kan have betydeligt mindre gavn af det på grund af konkurrerende risici for ikke-pludselig død (Sheldon et al.).
Programmering af ICD-behandlinger
ICD’er er typisk programmeret med flere zoner og funktioner til at optimere arytmidetektion og -behandling og samtidig minimere uhensigtsmæssige behandlinger. Indstillingerne omfatter følgende parametre:
- Overvågningszone: Til langsommere takykardier, der ikke kræver øjeblikkelig behandling.
- VT-zone: Til ventrikulære takykardier, der kan behandles med anti-takykardi-pacing (ATP).
- VF zone: Til hurtige, livstruende arytmier, der kræver stødbehandling.
Overvågningszonen aktiveres for at registrere og lagre højfrekvente ikke-vedvarende ventrikulære takykardier (NSVT), supraventrikulære takykardier (SVT’er) og langsomme ventrikulære takykardier (VT’er) for at vejlede om behandlingsbeslutninger. VT-zonen aktiveres ved forudbestemte ventrikelfrekvenser for at forsøge behandling med ATP-bursts. VF-zonen udløses, når der opstår ventrikelflimmer eller -fladder. Typiske indstillinger omfatter:
- VF-zone: ventrikulær arytmi ≥220-230 bpm
- Betinget/VT-zone: ≥200 bpm eller 10-20 bpm under VT-cykluslængden, hvis den er kendt.
For at undgå unødvendig behandling af selvafsluttende arytmier er detektionsvarigheden programmeret:
- VF-zone: 9-12 sekunder.
- VT-zone: 15-60 sekunder.
ATP og stødbehandling
Anti-takykardi-pacing (ATP) fungerer ved at levere pacede slag med en hastighed, der er lidt hurtigere end den registrerede takykardi, med det formål at afbryde det reentrante kredsløb, der er ansvarligt for takykardien. ATP er smertefri på grund af de lavenergipulser, der leveres. ATP er typisk programmeret til alle VT’er op til 250 slagger i minuttet. Stødbehandling er forbeholdt hurtigere rytmer, eller når ATP svigter. Programmeringsstrategier omfatter:
- Brug af ATP til VT’er op til 250 slag i minuttet, før der gives stød.
- Programmering af længere detektionstider for at tillade flere ATP-forsøg og potentiel selvafbrydelse af arytmier.
ATP-terapi har vist sig at være meget effektiv til at afslutte ventrikulær takykardi (VT) på tværs af flere studier:
- Den samlede succesrate for ATP varierer fra 80 % til 90 % for afslutning af VT’er. Den kumulative succesrate for ATP stiger med flere leverede sekvenser og når op på 87 % ved ≥8 sekvenser (Sterns et al.).
- ATP er særligt effektiv til langsommere VT’er med cykluslængder ≥320 ms og viser en succesrate på 88 % (Sterns etal.).
- Hos patienter med hjerteresynkroniseringsterapi viste ATP en konverteringsrate til sinusrytme på 90,5 % (Lozano et al.).
- Sammenligning af ATP-mønstre, burst og rampe har vist lignende effektivitet med succesrater på omkring 70-76 % (Maria et al.).
- Ved meget hurtige VT’er (cykluslængde 200-250 ms) kan differentieret ATP afslutte >50 % af episoderne (Zaman et al.).
- Det første ATP-forsøg alene kan afslutte 46 % af de monomorfe VT’er med succes (Knops etal.).
Diskriminering af SVT
Algoritmiske diskriminatorer anvendes på rytmer op til mindst 200 bpm for at differentiere SVT’er fra VT’er og undgå uhensigtsmæssige behandlinger. Disse diskriminatorer omfatter:
- Kriterier for pludselig debut.
- Analyse af rytmestabilitet.
- AV-associationsanalyse (i dobbeltkammerapparater).
- Diskriminering af morfologi.
Referencer
Nabel EG, Braunwald E. En fortælling om koronararteriesygdom og myokardieinfarkt. New England Journal of Medicine. 2012;366 (1):54-63.
Savarese G, Lund LH. Den globale folkesundhedsbyrde ved hjertesvigt. Cardiac Failure Review. 2017;3 (1):7-11.
McMurray JJ, Packer M, Desai AS, et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. New England Journal of Medicine. 2014;371 (11):993-1004.
McMurray JJ, Pfeffer MA. Hjertesvigt. Lancet. 2005;365 (9474):1877-1889.
Stewart S, Ekman I, Ekman T, Oden A, Rosengren A. Population Impact of Heart Failure and the Most Common Forms of Cancer: En undersøgelse af 1.162.309 hospitalsindlæggelser i Sverige (1988 til 2004). Cirkulation: Kardiovaskulær kvalitet og resultater. 2010;3 (6):573-580.
Packer M. Hjertesvigt: Den vigtigste, forebyggelige og behandlelige kardiovaskulære komplikation ved type 2-diabetes. Diabetes Care. 2018;41 (1):11-13.
Camici PG, Rimoldi OE. Dvale og hjertesvigt. Heart. 2004;90 (2):141-143.
Ezzati M, Riboli E. Adfærdsmæssige og ernæringsmæssige risikofaktorer for ikke-smitsomme sygdomme. New England Journal of Medicine. 2013;369 (10):954-964.
Suter TM, Ewer MS. Kræftmedicin og hjertet: Betydning og håndtering. European Heart Journal. 2013;34 (15):1102-1111.
Goldberg RJ, Spencer FA, Farmer C, et al. Epidemiologi af dekompenseret hjertesvigt i et enkelt samfund i det nordøstlige USA. American Journal of Cardiology. 2009;104 (3):377-382.
Mant J, Doust J, Roalfe A, et al. Systematic Review and Individual Patient Data Meta-Analysis of Diagnosis of Heart Failure, with Modelling of Implications of Different Diagnostic Strategies in Primary Care (Systematisk gennemgang og metaanalyse af individuelle patientdata om diagnosticering af hjertesvigt med modellering af konsekvenserne af forskellige diagnostiske strategier i primærsektoren). Vurdering af sundhedsteknologi. 2009;13 (32):1-207.
Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an Implantable Cardioverter-Defibrillator for Congestive Heart Failure. New England Journal of Medicine. 2005;352 (3):225-237.
Shah AD, Langenberg C, Rapsomaniki E, et al. Type 2 Diabetes and Incidence of Cardiovascular Diseases: A Cohort Study in 1.9 Million People. The Lancet Diabetes & Endocrinology. 2015;3 (2):105-113.
McMurray JJ, Gerstein HC, Holman RR, Pfeffer MA. Hjertesvigt: Et kardiovaskulært resultat ved diabetes, som ikke længere kan ignoreres. The Lancet Diabetes & Endocrinology. 2014;2 (10):843-851.
Benjamin EJ, Virani SS, Callaway CW, et al. Heart Disease and Stroke Statistics-2019 Update: A Report from the American Heart Association. Circulation. 2019;139 (10):e56-e528.
Centers for Disease Control and Prevention, National Center for Health Statistics. Underliggende dødsårsag, 1999-2017. Tilgået 7. januar 2019.
Det Europæiske Kardiologiske Selskab (ESC). 2021 ESC Guidelines on Cardiac Pacing and Cardiac Resynchronization Therapy. European Heart Journal, 2021;42 (35):3427-3520.
American College of Cardiology (ACC). 2021 ESC-retningslinjer for pacing og CRT: Nøglepunkter. ACC.org, 2021.
Moss AJ, Zareba W, Hall WJ, et al. Profylaktisk implantation af en defibrillator hos patienter med myokardieinfarkt og reduceret ejektionsfraktion. New England Journal of Medicine, 2002;346 (12):877-883.
Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. New England Journal of Medicine, 2005;352 (3):225-237.
Det Europæiske Kardiologiske Selskab (ESC). Forebyggelse af pludselig hjertedød ved hjælp af implanterbare cardioverter-defibrillatorer efter myokardieinfarkt. E-Journal of Cardiology Practice, 2009;7 (29).
Den amerikanske hjerteforening (AHA). Implanterbare kardioverter-defibrillatorer til primær forebyggelse. Cirkulation: Arrhythmia and Electrophysiology, 2012;5 (5):e74-e80.
American College of Cardiology (ACC). Behandling af hjertesvigt ICD og CRT. ACC.org, 2014.
Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities (retningslinjer for udstyrsbaseret behandling af hjerterytmeforstyrrelser). Journal of the American College of Cardiology, 2008;51 (21):e1-e62.
Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death (retningslinjer for behandling af patienter med ventrikulære arytmier og forebyggelse af pludselig hjertedød). Circulation, 2018;138 (13):e272-e391.
Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death (ESC-retningslinjer for behandling af patienter med ventrikulære arytmier og forebyggelse af pludselig hjertedød). European Heart Journal, 2015;36 (41):2793-2867.
Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death (retningslinjer for behandling af patienter med ventrikulære arytmier og forebyggelse af pludselig hjertedød). Journal of the American College of Cardiology, 2006;48 (5):e247-e346.
Kusumoto FM, Schoenfeld MH, Barrett C, et al. 2018 ACC/AHA/HRS guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay. Journal of the American College of Cardiology, 2019;74 (7):e51-e156.
Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal, 2013;34 (29):2281-2329.
Wilkoff BL, Cook JR, Epstein AE, et al. Dual-chamber pacing eller ventricular backup pacing hos patienter med en implanterbar defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA, 2002;288 (24):3115-3123.
Kuck KH, Cappato R, Siebels J, et al. Randomiseret sammenligning af antiarytmisk lægemiddelbehandling med implanterbare defibrillatorer hos patienter, der er genoplivet efter hjertestop: Cardiac Arrest Study Hamburg (CASH). Circulation, 2000;102 (7):748-754.
Connolly SJ, Gent M, Roberts RS, et al. Canadian Implantable Defibrillator Study (CIDS): et randomiseret forsøg med den implanterbare cardioverter-defibrillator mod amiodaron. Circulation, 2000;101 (11):1297-1302.
Buxton AE, Lee KL, Fisher JD, et al. En randomiseret undersøgelse af forebyggelse af pludselig død hos patienter med koronararteriesygdom. New England Journal of Medicine, 1999;341 (25):1882-1890.
Moss AJ, Hall WJ, Cannom DS, et al. Forbedret overlevelse med en implanteret defibrillator hos patienter med koronararteriesygdom med høj risiko for ventrikulær arytmi. New England Journal of Medicine, 1996;335 (26):1933-1940.
Klein H, Arnsdorf M, Brugada P, et al. Forbedret overlevelse med en implanteret defibrillator hos patienter med koronar sygdom med høj risiko for ventrikulær arytmi. New England Journal of Medicine, 1996;335 (26):1933-1940.
The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. En sammenligning af antiarytmisk lægemiddelbehandling med implanterbare defibrillatorer hos patienter, der er blevet genoplivet efter næsten dødelige ventrikulære arytmier. New England Journal of Medicine, 1997;337 (22):1576-1583.
