Tromboembolisme i hjertet
Tromboembolisme er en af de hyppigste dødsårsager på verdensplan (1). Embolier med oprindelse i atrierne, venstre atrial appendage (LAA), ventriklerne, klapperne og den proksimale aorta kan forårsage slagtilfælde, TIA (forbigående iskæmisk anfald), koronararterieokklusion og perifer embolisering. Slagtilfælde er den tredjestørste dødsårsag i de vestlige lande, og ultralydsundersøgelser udføres nu hos de fleste patienter med slagtilfælde eller TIA. Formålet med at udføre en ultralydsundersøgelse er at undersøge potentielle hjertekilder til emboli og at evaluere halspulsårerne og hjernearterierne. Ultralyd kan afsløre aterosklerotiske plaques, tromber, okklusioner og dissektioner.
Slagtilfælde inddeles i hæmoragisk slagtilfælde (13 % af alle tilfælde) og iskæmisk slagtilfælde (87 % af alle tilfælde). Udtrykkene hæmoragisk apopleksi og intracerebral blødning bruges i flæng. Hæmoragisk slagtilfælde indebærer blødning direkte ind i hjernens parenkym. Den mest almindelige underliggende ætiologi er forhøjet blodtryk. Iskæmisk slagtilfælde opstår, når en cerebral arterie er okkluderet på grund af lokal aterotrombose eller okklusion på grund af embolisering. Omkring 30 % af alle iskæmiske slagtilfælde er forårsaget af hjerteemboli. Dette tal omfatter ikke paradoksal emboli (omtalt nedenfor) og emboli fra den proksimale aorta.
Slagtilfælde og TIA (forbigående iskæmisk anfald)
Iskæmisk apopleksi udgør 87 % af alle apopleksitilfælde og opdeles yderligere i følgende kategorier:
- Lakunært slagtilfælde eller lakunært infarkt (okklusion af små gennemtrængende arterier): Dette er den mest almindelige form for iskæmisk slagtilfælde, som skyldes okklusion af små gennemtrængende arterier, der forsyner dybe strukturer med blod. Lakunære slagtilfælde resulterer i fem klassiske lakunære syndromer, nemlig:
- (1) rent motorisk slagtilfælde/hemiparese
- (2) ataktisk hemiparese
- (3) dysartri
- (4) rent sensorisk slagtilfælde
- (5) blandet sensomotorisk slagtilfælde.
- Kardioembolisk slagtilfælde
- Tromboembolisme forbundet med cerebral aterosklerose.
- Kryptogent slagtilfælde: Disse tilfælde har ingen kendt mekanisme.
- Paradoksal emboli: Paradoksal emboli opstår, når tromboembolisk materiale transporteres fra det venøse kredsløb til det arterielle kredsløb, f.eks. via et persisterende foramen ovale (PFO), som muliggør blodgennemstrømning fra højre til venstre atrium.
Ekkokardiografi er vigtig ved kardioembolisk slagtilfælde, kryptogent slagtilfælde og ved emboli, der opstår i den proksimale aorta.
Kardioemboli er årsag til 30 % af alle iskæmiske slagtilfælde.
Embolisk materiale
Hjerteemboli kan bestå af følgende materialer:
- Koaguleret blod
- Tumorvæv
- Fragmenter fra vegetationer (septiske eller aseptiske vegetationer)
- Fragmenter af forkalkninger
- Aterosklerotisk affald
Embolisk potentiale
Talrige tilstande kan give anledning til emboli i hjertet. Disse tilstande kan rangeres efter deres emboliske potentiale. Tilstande med et højt embolisk potentiale medfører en høj risiko for emboli og omvendt. Tabel 1 viser disse tilstande.
| TABEL 1. KILDER TIL HJERTEEMBOLI OG EMBOLISK POTENTIALE |
| HØJT EMBOLISK POTENTIALE |
| Atriearytmier – især atrieflimren og atrieflagren. |
| Iskæmisk hjertesygdom – Både akut og kronisk iskæmisk hjertesygdom (inklusive komplikationer) kan forårsage embolier. |
| Venstre ventrikel aneurisme med trombe |
| Kardiomyopatier |
| Ventilproteser |
| Apparater (pacemaker, ICD CRT) |
| Endokarditis |
| Hjertetumorer |
| Aterosklerose i aorta |
| LAVT EMBOLISK POTENTIALE |
| SEP (Spontant ekkokardiografisk potentiale) |
| Venstre ventrikel aneurisme uden trombe |
| Prolaps af mitralklappen |
| Aortastenose med forkalkning |
| Mitralsygdom med forkalkning |
| Fibrintråde |
| Kæmpe Lambls-udposninger |
| Septumdefekter – PFO, ASA, ASD |
Ekkokardiografi til undersøgelse af kardiale embolikilder
Formålet med ekkokardiografi er at undersøge, om der er kilder til emboli i hjertet, og hvis patienten har haft et slagtilfælde/TIA, at vurdere, om den emboliske kilde er den mest sandsynlige årsag til hændelsen. Ekkokardiografisk vurdering af embolikilder i hjertet kræver omhyggelig billeddannelse og kendskab til differentialdiagnoser. Ekkokardiografi udføres typisk ved hjælp af todimensionel (2D) ultralyd, men 3D-ultralyd bliver mere og mere velegnet i denne sammenhæng. Hvis der er mistanke om en trombe i ventrikelhulen, kan man bruge kontrast til at forbedre billedopløsningen.
Transthorakal ekkokardiografi (TTE) giver oftest et tilstrækkeligt billede af ventriklerne. TTE giver dog ikke en tilstrækkelig god opløsning af atrierne, auriklerne, atrieseptum og aorta. Hvis man har mistanke om, at embolikilden befinder sig i et af disse områder, skal man vælge TEE (transøsofageal ekkokardiografi). Med TEE får man et betydeligt bedre billede af atrierne og aorta. Generelt har TEE højere sensitivitet og specificitet for alle emboliske kilder med undtagelse af apikale tromber i venstre ventrikel, som bedst ses med TTE.
TEE bør foretrækkes ved mistanke om posteriort beliggende embolus (venstre atrium, SEC [spontaneous echo contrast], aortaplaques, ventilproteser, vegetationer, defekter i interatrial septum, tumorer). TTE foretrækkes i tilfælde af mistanke om en trombe i venstre ventrikel.
Tromboemboli fra venstre forkammervedhæng
Venstre atrium og venstre atrial appendage er de mest almindelige kilder til hjerteemboli. Trombedannelse er stærkt forbundet med atrielle arytmier (atrieflimren, atrieflagren), og langt størstedelen af tromberne opstår i venstre atrielle appendix. Man mener, at langsom blodgennemstrømning i appendixet resulterer i trombose (stase fremmer koagulation). Omkring 75 % af alle hjerteembolier stammer fra venstre atriale appendage, og dette sted bør være den primære mistanke hos patienter med atrieflimren (2).
Morfologi af venstre atrial appendage
Det er blevet foreslået, at der findes mindst fire forskellige morfologiske varianter af venstre atrial appendage. Di Biase et al. undersøgte forskellige anatomiske varianter, deres prævalens, og hvordan de korrelerede med risiko for slagtilfælde og TIA (3, 4). De rapporterer, at 30 % var kaktusformede, 48 % var kyllingevingeformede, 19 % var vindposeformede og 3 % var blomkålsformede. Kyllingevinge-morfologi var forbundet med den laveste risiko for slagtilfælde/TIA (79 % mindre sandsynlighed for at have en slagtilfælde/TIA-historie).
Atrieflimren og kardioemboli
Selv om det er klart, at 75 % af alle kardioembolier stammer fra det venstre atriale vedhæng, og de fleste tilfælde opstår under episoder med atrieflimren, er de nøjagtige mekanismer bag trombosen stadig stort set ukendte. Ifølge Virchows triade er der tre faktorer, der forårsager trombose:
- Hæmodynamiske ændringer (stase, turbulens)
- Endothelskade eller -dysfunktion – beskadiget endothel udsætter kollagen for blodstrømmen, hvilket resulterer i en reaktion mellem kollagen og von Willebrand-faktor og dermed blodpladeaktivering.
- Hyperkoagulabilitet – enhver prokoagulerende tilstand eller substans
Stase i blodgennemstrømningen forekommer ofte i venstre atrium og venstre atrial appendix. En mild form for stase er SEC (spontaneous echo contrast), som typisk visualiseres med TEE og mindre ofte med TTE. SEC opstår, når blodgennemstrømningen i atriet er langsom, hvilket får erytrocytterne til at klæbe til hinanden og danne rouleaux-aggregater. SEC ser ud som røg på 2D-billedet og er meget almindeligt under episoder med atrieflimren.
Atrieflimren resulterer i en reduktion af den effektive atriale kontraktile funktion, hvilket er hovedforklaringen på stase af flowet under flimren. Stase kan dog også forekomme under sinusrytme i forbindelse med forstørrelse af venstre atrium, som kan være sekundær til hjerteklapsygdom (f.eks. mitralklapstenose).
Hvis blodgennemstrømningen falder yderligere, omdannes SEC til sludge, hvilket betyder, at røgen er meget tæt.
SEC defineres som røg i ultralydsbilledet. Slam defineres som tæt røg. En trombe er en tydelig masse.
Emboli og elektrisk kardioversion
Patienter med permanent atrieflimren bør ikke gennemgå elektrisk kardioversion, da flimren hurtigt kommer tilbage. Elektrisk kardioversion kan forsøges hos patienter med paroxysmal atrieflimren. Enhver kardioversion indebærer en risiko for embolisering. Der er to mulige mekanismer bag emboliske hændelser efter kardioversion:
- Embolisering opstår, når sinusrytmen genoprettes, og atriets kontraktilitet vender tilbage; sammentrækningerne fører til frigørelse af en tidligere dannet trombe.
- Kardioversion kan resultere i atrial stunning, hvilket fremgår af øget SEC efter kardioversion, hvilket resulterer i blodstase og trombedannelse (Black et al, Grimm et al).
Nuværende retningslinjer (AHA, ESC 2019-2020) antyder, at arytmiens varighed og CHADS-VASC-score er de vigtigste prædiktorer for kardioemboli efter kardioversion. Med hensyn til arytmiens varighed antages det, at jo længere tid atrieflimren har varet, jo større er sandsynligheden for, at der dannes tromber i forkamrene.
De fleste retningslinjer har anbefalet, at hvis varigheden af arytmien er <48 timer, kan patienten kardioverteres subakut (dvs. på det tidspunkt, hvor antikoagulation med NOAC eller warfarin påbegyndes). Hvis arytmien har varet i mere end 48 timer, skal antikoaguleringen påbegyndes og fortsætte i 3-4 uger, før der gøres forsøg på kardioversion. Formålet med 3-4 ugers antikoagulationsbehandling er at opløse eventuelle tromber i forkammeret, før der forsøges kardioversion. Hvis arytmiens varighed er usikker, eller hvis kardioversion skal udføres tidligt, kan TEE (transøsofageal ekkokardiografi) bruges til at undersøge tilstedeværelsen af tromber i atriet og venstre atrial appendage (Airaxsinen et al, Alastair et al, Kirchoff, etc.). Det antages, at en negativ TEE-undersøgelse udelukker tilstedeværelsen af tromber i venstre atrium og venstre atrial appendage, således at kardioversion kan udføres uanset arytmiens varighed.
Bemærk, at grænsen på 48 timer ikke er baseret på robuste kliniske data. Jo længere varigheden af arytmien er, desto større er risikoen for kardioemboli.
Ekkokardiografisk vurdering af venstre forkammervedhæng
Vurdering af venstre atrium og appendiks bør afgøre, om atriet er forstørret. Dette kan gøres ved at måle atriets diameter (anteroposterior diameter) eller estimere atriets volumen (kan justeres for kroppens overfladeareal [BSA]). TEE bør være den foretrukne metode til disse målinger; TEE har betydeligt højere sensitivitet og specificitet for atriale tromber sammenlignet med TTE. Som tidligere nævnt kan TEE bruges til at udelukke atriale tromber før kardioversion hos patienter med atrieflimren/flutter. I udvalgte tilfælde kan undersøgelsen udvides med kontrast eller tredimensionel (3D) TEE.
Tromboemboli fra venstre ventrikel
Akut myokardieinfarkt (AMI)
Stort set alle myokardieinfarkter rammer venstre ventrikel, og betegnelserne anterior , lateral, septal og inferior myokardieinfarkt refererer til de fire vægge i venstre ventrikel. Højre hjertekammer skånes i de fleste tilfælde. Højre ventrikelinfarkt opstår, hvis okklusionen er placeret i det proksimale segment af den højre koronararterie, således at r. marginalis dx (højre marginale gren) påvirkes.
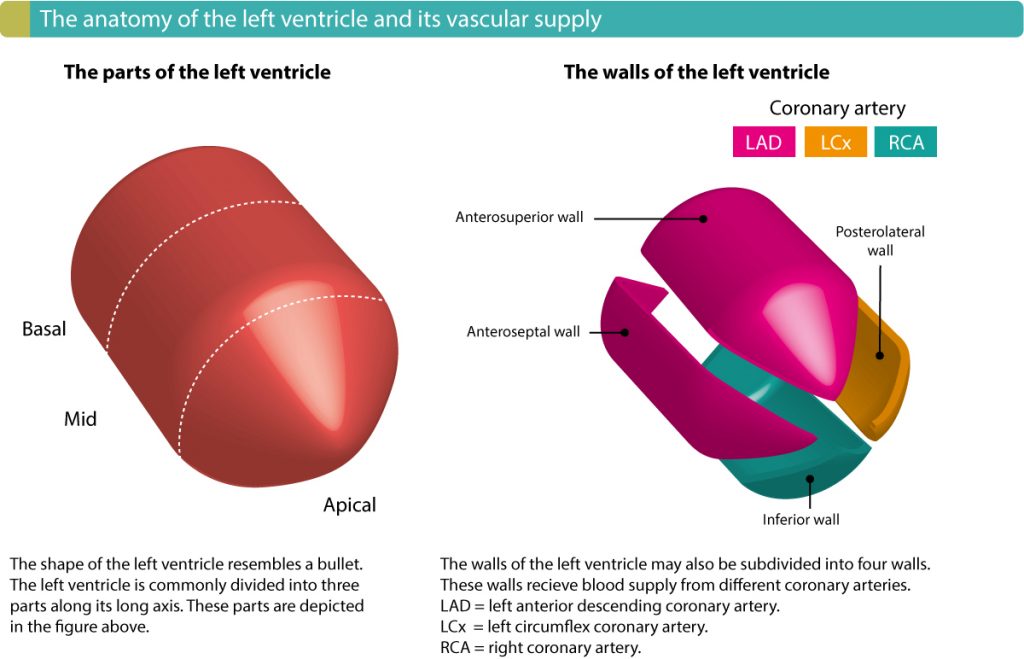
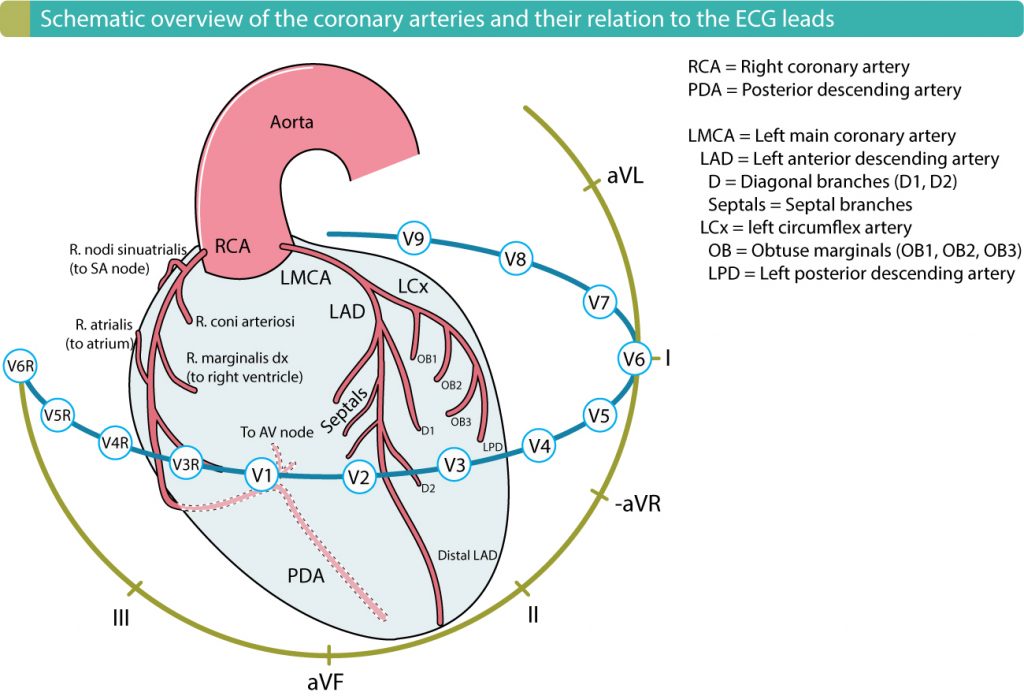
Anbefalet kapitel: Lokalisering af akut myokardieinfarkt ved hjælp af EKG.
Kontraktionsevnen ophører permanent i det inkarnerede myokardium. Afhængigt af infarktets omfang vil den berørte væg udvise varierende grader af vægbevægelsesabnormiteter. Hastigheden af blodgennemstrømningen over det inkarnerede område vil blive reduceret, og sammen med vævsskaden og den potentielt protrombogene tilstand vil det fungere som en nidus for trombedannelse. Tromber dannes typisk inden for 24 timer efter udbruddet af myokardieinfarkt; 90 % af alle tromber dannes inden for 10 dage. Risikoen for trombedannelse i venstre ventrikel er særlig stor i forbindelse med aneurisme eller forstørrelse af venstre ventrikel. Op til 50 % af alle tilfælde af aneurisme i venstre ventrikel viser tromber. Blandt patienter med akut koronarsyndrom har 5-15 % tromber i venstre ventrikel (Chiarella et al, Solheim et al, Weinsaft et al).
Risikofaktorer for trombose i venstre ventrikel:
- Dilatation af venstre ventrikel.
- Forreste AMI.
- Stort AMI.
- Nedsat ejektionsfraktion (EF).
- SEC (spontan ekkokontrast) i den ventrikulære kavitet.
Kardiomyopati
Alle patienter med kardiomyopati har en øget risiko for trombose i venstre ventrikel. Risikoen er størst, hvis venstre ventrikel er udvidet.
Typer af tromber i venstre ventrikel
- Murale tromler: En mural trombe er en flad masse, der ligger langs myokardiet. Disse tromler har den laveste risiko for embolisering.
- Fremspringende tromber: En fremspringende trombe stikker ind i ventrikelhulen.
- Mobil tromle: En mobil tromle stikker ud i ventrikelhulen og svinger frem og tilbage. Disse tromler har den største risiko for embolisering.
Ekkokardiografi til visualisering af tromber i venstre ventrikel
Transthorakal ekkokardiografi (TTE) er fremragende til at opdage tromber i venstre ventrikel. TTE har 95 % sensitivitet og 85-90 % specificitet. Tromben skal visualiseres på mindst to forskellige måder. Den ser ud som en masse, der sidder hurtigt på endokardiets overflade, med eller uden en fremspringende del. Myokardiet viser typiske abnormiteter i vægbevægelsen.
Kardioemboli ved valvulær hjertesygdom
Native og protetiske klapper kan forårsage emboliske hændelser gennem trombedannelse eller løsrivelse af vegetationer (endokarditis) eller forkalkninger.
Septisk endokarditis
Endokarditis er en almindelig årsag til kardioemboli. Mikroemboli kan forekomme, selv om der ikke er synlige vegetationer. Jo større vegetationerne er, jo større er de udsendte fragmenter (Thuny et al.).
Aseptisk endokarditis
Libman-Sacks endokarditis (verrukøs endokarditis)
Libman-Sacks endokarditis ligner bakteriel endokarditis på ekkokardiografi. Denne endokarditis er dog aseptisk (ikke-bakteriel), og vegetationen består af immunceller, hæmatoxyllegemer, koagulationsfaktorer og trombocytter. Libman-Sacks endokarditis resulterer ikke i klapdestruktion og er derfor mindre akut end bakteriel endokarditis. De fleste patienter med Libman-Sacks endokarditis har milde symptomer, hvilket kan forklares med de små hæmodynamiske effekter af denne endokarditis. Langt de fleste patienter, der udvikler Libman-Sacks endokarditis, har SLE (systemisk lupus erythematosus). Antifosfolipidsyndrom er også forbundet med Libman-Sacks endokarditis.
Denne endokarditis påvirker typisk mitral- og/eller aortaklappen. Det er vanskeligt at skelne Libman-Sacks endokarditis fra bakteriel endokarditis. Desuden kan disse ikke-bakterielle vegetationer blive koloniseret af bakterier og dermed udvikle sig til bakteriel endokarditis.
Embolisering er sjælden ved Libman-Sacks endokarditis.
Marantisk endokarditis
Udtrykket marantisk stammer fra sygdommen marasme, som er en tilstand forårsaget af alvorlig underernæring (primært på grund af proteinmangel). Marasme er blevet sjælden, selv i lavindkomstlande. I den vestlige verden er marantisk endokarditis en paraneoplastisk manifestation af karcinomer; de mest almindelige underliggende kræftformer er lungekræft, kræft i bugspytkirtlen og kræft i mavesækken (ventrikelkræft). Disse kræftformer resulterer i hyperkoagulerbart blod, hvilket fører til ophobning af fibrin og trombocytter på ventilerne.
Strands og Lambls ekskrescenser
Strands og Lambls ekskrescenser er sandsynligvis almindelige i befolkningen. Nogle undersøgelser tyder på, at op til 50 % af alle individer har disse strukturer (Roldan et al.), som er fibrøse tråde, der typisk forekommer ved mitralklappens eller aortaklappens koaptationslinjer. Strengene består af kollagen, elastin og et ydre endotel-lag. De er normalt 2 mm i diameter og 3 til 10 mm lange. Strenge, der sidder på mitralklappen, ses normalt i venstre atrium, og dem, der sidder på aortaklappen, ses typisk i LVOT. Strenge og Lambls ekskrescenser er sjældne på pulmonalklappen og tricuspidalklappen.
Transøsofageal ekkokardiografi (TEE) er guldstandarden for diagnosticering af strands og Lambls excrescences, selv om metoden ikke gør det muligt at skelne mellem strands og excrescences.
Strands og Lambls excrescences forårsager sjældent tromboembolisme.
Forkalkning af mitral annulus
Mitralringen kan blive forkalket. En forkalket mitral annulus fremstår som en tyk og uregelmæssig annulus med høj ekkogenicitet ved ekkokardiografi. Forkalkninger er mest udtalte på det segment, der fastgør den bageste folde. Forkalkninger ses bedst med transthorakal ekkokardiografi (TTE).
Forkalkninger er forbundet med en øget risiko for kardial tromboembolisme, hvilket forklares af følgende mekanismer:
- Forkalkninger prædisponerer for bakteriel endokarditis.
- Forkalkninger er forbundet med aterosklerose i koronararterier, cerebrale arterier og andre arterier. Aterosklerotiske plaques kan briste og dermed føre til aterotrombose og arterieokklusion.
- Forkalkninger kan tjene som nidus for trombedannelse, og trombotiske fragmenter kan løsne sig og embolisere.
- Forkalkninger er forbundet med atrial dilatation (forstørrelse) og dermed atrieflimren, hvilket igen øger risikoen for tromboemboli.
Proteseklapper
Mekaniske ventilationsproteser er forbundet med en meget høj risiko for tromboemboli, og derfor er antikoagulation grundlæggende for disse personer. Den årlige forekomst af trombose er 1,0-2,0 % blandt personer med mekaniske klapper, hvor den højeste risiko ses ved mekaniske tricuspidal- eller mitralklapper. I de fleste af disse tilfælde sker trombedannelsen under episoder med subterapeutisk antikoagulation. Forekomsten af trombose er ca. 0,5-1,0 % for biologiske klapper.
Det skal bemærkes, at tromboemboli på pulmonal- og tricuspidalklappen forårsager lungeemboli, mens tromboemboli på venstre side forårsager emboli i det systemiske kredsløb.
Hjertetumorer
Primære hjertetumorer opstår i hjertevævet. Disse tumorer er for det meste godartede, men udgør en høj risiko for tromboemboli. Myxom og papillært fibroelastom (PFE) er de mest udbredte hjertetumorer. Sådanne tumorer kan forårsage tromboembolisme, hvis tumormassen løsner sig, eller hvis der dannes tromber på den.
Myxom
Ca. 75 % af alle myxomer forekommer i venstre atrium, og disse tumorer har typisk en stilk, der er fastgjort til fossa ovalis. Ca. 30 % af alle myxomer resulterer i tromboembolisme.
Papillært fibroelastom (PFE)
Papillært fibroelastom (PFE) er forbundet med en høj risiko for tromboemboli. Omkring 80 % af alle papillære fibroelastomer udvikler sig på klapperne, mest på aortaklappen og mitralklappen. PFE’er på aortaklappen er typisk synlige i aortaroden, og dem på mitralklappen ses for det meste i venstre ventrikelhulrum.
Ondartede hjertetumorer
Sarkom er den mest almindelige ondartede hjertetumor. Disse tumorer er oftest lokaliseret på højre side og giver en høj risiko for lungeemboli.
Emboli fra aorta
Transtorakal ekkokardiografi (TTE) og transøsofageal ekkokardiografi (TEE) kan visualisere store dele af aorta og belyse kilder til tromboembolisme. Langt størstedelen af alle embolier fra aorta stammer fra aterosklerotiske plaques. Sådanne plaques (ateromer) er placeret i det inderste lag af væggen, dvs. intima (tunica intima). Udviklingen af plaques begynder i ungdomsårene og fremskyndes af risikofaktorer som diabetes (type 1, type 2), insulinresistens, forhøjet blodtryk, rygning, hyperkolesterolæmi (dyslipidæmi) og genetiske varianter. LDL-kolesterol spiller en grundlæggende rolle i udviklingen af aterosklerose (Libby et al., Ference et al.). Den aterosklerotiske plak består af lipider, immunceller (makrofager, T-celler, B-celler) og cellulært affald. Plaques er sårbare, hvilket betyder, at de kan briste eller få sår. Plaquebyrden (mængden af aterosklerose) stiger typisk i retning fra den proksimale til den distale aorta. Risikoen for emboli korrelerer stærkt med plakbyrden. Følgende mekanismer fører til tromboembolisme:
- Trombose – ruptur eller ulceration af en aterosklerotisk plak fører til trombedannelse og emboli.
- Kolesterolemboli – nogle plaques har en meget høj kolesterolkoncentration, som fører til dannelse af krystaller. Kolesterolkrystaller kan løsne sig og dermed forårsage emboli.
Aortatrombose kan resultere i store embolier, der lukker store arterier. Slagtilfælde, TIA, nyreinfarkter, intestinal iskæmi og iskæmi i lemmerne er almindelige ved aortatrombose.
Kolesterolemboli resulterer i embolisering af små krystaller, som fører til okklusion af distale (mindre) arterier. Flere embolier kan forekomme samtidigt. Almindelige komplikationer er nyresvigt, mindre hjerneinfarkter, mild iskæmi i lemmerne osv.
Transthorakal ekkokardiografi (TTE) giver mulighed for visualisering af aortaklappen og den opstigende aorta. Dette er utilstrækkeligt til at evaluere plakbyrden og eksistensen af aortatromber. Transøsofageal ekkokardiografi (TEE) er nødvendig for at visualisere den opstigende aorta, aortabuen og den nedstigende aorta. TEE giver også en større opløsning af aortaroden. TEE giver dog ikke mulighed for at visualisere aortasegmentet lige proksimalt for a. brachiocephalica (arteria brachiocephalica), hvilket skyldes, at dette segment er skjult af højre bronkus og luftrøret. TEE giver normalt mulighed for at visualisere aorta ned til a. mesenterica superior (arteria mesenterica superior). MR eller CT kan lejlighedsvis være nødvendigt for at opnå tilfredsstillende billeder.
Paradoksal emboli
Paradoksal embolisering betyder, at en embolus i det venøse system ender i det arterielle system og forårsager en okklusion på arteriesiden. Dette kan ske, hvis der er kommunikation mellem højre og venstre hjertehalvdel. Eksempler på sådanne forbindelser er:
- PFO (Homma et al.)
- ASD
PFO (persisterende foramen ovale)
Atriets septum dannes af to strukturer, septum primum og septum secundum. I løbet af fosterlivet adskilles septum primum og septum secundum, hvilket giver anledning til en kanal, der fungerer som en kileventil, mellem atrierne; denne kanal er foramen ovale. Under fosterlivet er foramen ovale afgørende for, at det iltrige blod fra moderkagen kan passere fra vena cava inferior til højre atrium og direkte til venstre atrium. Ved fødslen lukkes foramen ovale og septum, og det andet vokser sammen. Lukningen forklares med, at trykket på venstre side stiger dramatisk efter fødslen, hvilket resulterer i, at kileventilen ikke kan åbnes, og derefter sker der en gradvis forsegling af septum primum og secundum. Lukningen bliver dog ufuldstændig hos 25 %, og der er stadig et vindue mellem højre og venstre forkammer. Dette vindue kaldes persist foramen ovale (PFO). Da PFO har en prævalens på 25 %, kan det ses som en normal variant. PFO er ofte ledsaget af en aneurisme i septum primum. Selve åbningen udviser stor variation. Nogle PFO’er er meget store, mens andre er små tunneler.
PFO har ingen hæmodynamisk betydning, men kommunikation kan føre til, at emboli i højre atrium kommer ind i venstre atrium. Således kan embolier dannet i venerne (for eksempel i benene) passere fra højre til venstre atrium og fremkalde okklusioner i det systemiske kredsløb (på siden af arterien). Dette kaldes paradoksal embolisering.
I situationer med øget tryk i højre side udviser personer med PFO-shunting, hvilket betyder, at blodet strømmer fra højre til venstre atrium. Det betyder, at der f.eks. ved pulmonal hypertension eller Valsalva-manøvre ses en strømning fra højre til venstre atrium.
ASA (atrial septal aneurisme)
ASA betyder, at det område, der svarer til fossa ovalis, stikker ud fra midterlinjen. Aneurismet kan være hurtigt eller bølgende. ASA antager at øge risikoen for paradoksal embolisering. Potentielt store aneurismer kan faktisk være grobund for trombose, fordi blodet står stille i aneurismet.
Kryptogent slagtilfælde
Kryptogent slagtilfælde betyder, at man ikke kan fastslå årsagen til slagtilfældet. Ved kryptogent slagtilfælde er paradoksal embolisering en almindelig mistanke. PFO er mere almindeligt blandt personer med kryptogent slagtilfælde. Op til 40 % af patienter med kryptogent slagtilfælde har PFO, hvilket gør en tilbøjelig til at forklare slagtilfælde med paradoksal embolisering. Det er dog ofte vanskeligt at fastslå med sikkerhed, at dette er årsagen.
Lungeemboli (PE)
Lungeemboli er den tredje mest almindelige kardiovaskulære dødsårsag efter akut myokardieinfarkt og slagtilfælde. Omkring 90-95 % af alle lungeembolier opstår i venerne, især i benene. Andre årsager til lungeemboli er endokarditis, tumorassocieret trombose eller trombose på elektroder. Dødeligheden ved lungeemboli er 10 %, hvilket er betydeligt højere end dødeligheden ved STEMI (6-7 %) og NSTEMI (5 %). Dødsmekanismen ved lungeemboli er kredsløbskollaps som følge af en embolus, der forhindrer blodgennemstrømning gennem lungekredsløbet.
Lungeemboli diagnosticeres typisk med CT. Ekkokardiografi kan bruges til risikostratificering. Ved ekkokardiografi skal følgende tegn på lungeemboli genkendes:
- Tilstedeværelse af tromber i vena cava inferior, levervener, højre hjerte.
- Højre ventrikelstamme (RV-stamme): Ekkokardiografiske tegn på belastning af højre ventrikel er dilatation og dysfunktion af højre ventrikel. Dilatation defineres som højre ventrikel, der er mindst lige så stor som venstre ventrikel.
- Paradoksal septumbevægelse, som indebærer, at septum buler ind i venstre ventrikel.
- Udvidede proksimale lungearterier.
- Forhøjet tryk i højre ventrikel.
- Unormal tricuspid regurgitation (TI).
- Forhøjet tryk i højre atrium, som ses som dilateret vena cava inferior, uden respiratorisk kollaps.
- McConnells tegn: bevaret apikal kontraktilitet i højre ventrikel, men nedsat basal og midtventrikulær kontraktilitet.
Ingen ultralydsmetode kan bruges til at udelukke lungeemboli.
Klassificering af lungeemboli
- Massiv lungeemboli: lungeemboli med hypotension.
- Submassiv lungeemboli: Lungeemboli uden hypotension, men med tegn på RV-stamme eller forhøjede hjertetroponiner.
- Lavrisiko-lungeemboli: ingen af ovenstående.
Dilatation af højre ventrikel ses også ved følgende tilstande:
- KOL (kronisk obstruktiv lungesygdom).
- Cor pulmonale (astma)
- Pulmonal hypertension.
- Søvnapnø.
- Højre hjertesvigt.
- Myokardieinfarkt i højre ventrikel.
Referencer
1. Global, regional og national alders- og kønsspecifik dødelighed for 282 dødsårsager i 195 lande og territorier, 1980-2017: en systematisk analyse til Global Burden of Disease Study 2017. GBD 2017-samarbejdspartnere for dødsårsager
2. Saric et al: Retningslinjer for brug af ekkokardiografi i evalueringen af en kardial kilde til emboli. Journal of the American Society of Echocardiography.
3. Di Biase Thrombogenic and Arrhythmogenic Roles of the Left Atrial Appendage in Atrial Fibrillation Clinical Implications. Cirkulation 2018
4. Di Biase: Korrelerer morfologien i venstre atrial appendix med risikoen for slagtilfælde hos patienter med atrieflimren? Resultater fra et multicenterstudie. JACC 2012.
