Hypertrofisk kardiomyopati (HCM) og hypertrofisk obstruktiv kardiomyopati (HOCM)
Hypertrofisk kardiomyopati (HCM): fra patofysiologi til ekkokardiografi
Hypertrofisk kardiomyopati er en genetisk lidelse, der forårsager venstre ventrikelhypertrofi under normale belastningsforhold. Hypertrofisk kardiomyopati bør ikke forveksles med hypertrofi forårsaget af øgede belastningsforhold. Øget ventrikelbelastning er for det meste forårsaget af systemisk hypertension eller aortastenose. Ved forhøjet blodtryk gør den øgede systemiske modstand det sværere for ventriklen at skubbe blod ud i aorta under systolen. Ved aortastenose er der øget modstand i selve aortaklappen på grund af det reducerede areal af klappeåbningen. Både aortastenose og hypertension resulterer i øget ventrikulær belastning, som ventriklen modvirker ved at udvikle hypertrofi.
Hypertrofisk kardiomyopati indebærer venstre ventrikelhypertrofi under normale belastningsforhold.
Anbefalet læsning
– Forholdet mellem ventrikulært tryk og volumen: Forbelastning, efterbelastning, slagvolumen, vægspænding og Frank-Starlings lov
– Myokardiets mekanik
Det er vigtigt at skelne mellem hypertrofisk kardiomyopati og hypertrofi forårsaget af øgede belastningsforhold. Sidstnævnte er langt mere almindelig, og tilstandene kan eksistere samtidig. En betydelig procentdel af befolkningen har forhøjet blodtryk, og aortastenose er også mere almindelig end hypertrofisk kardiomyopati (især blandt ældre). Patientkarakteristika og graden af hypertrofi kan bruges til at skelne mellem hypertrofisk kardiomyopati og hypertrofi forårsaget af belastningsforhold. Ved øget belastning bør man mistænke hypertrofisk kardiomyopati, hvis graden af hypertrofi er disproportional i forhold til belastningen (dvs. hvis hypertrofien er mere udtalt, end belastningen med rimelighed kan forklare). Sandsynligheden for hypertrofisk kardiomyopati er omvendt relateret til alder, således at jo yngre en patient med hypertrofi er, desto mere sandsynligt er det, at der er tale om en genetisk ætiologi.
De genetiske mekanismer, der ligger til grund for hypertrofisk kardiomyopati, er komplicerede, og nogle genvarianter kan kun forårsage hypertrofi under bestemte belastningsforhold (dvs. i nærvær af øget belastning). Derfor kan nogle tilfælde af hypertrofisk kardiomyopati være resultatet af en uforholdsmæssig stor reaktion på øget ventrikulær belastning.
Tilstedeværelsen af systemisk hypertension eller aortastenose udelukker ikke hypertrofisk kardiomyopati.
Epidemiologiske aspekter af hypertrofisk kardiomyopati (HCM)
Hypertrofisk kardiomyopati er lige almindelig blandt mænd og kvinder. Prævalensen i en vestlig befolkning er ca. 0,2 %. Hypertrofisk kardiomyopati er en af de mest almindelige årsager til hjertestop og pludselig hjertedød (SCD) blandt unge mennesker. Blandt atleter er hypertrofisk kardiomyopati den mest almindelige årsag til pludselig hjertedød. Derfor lægger de nuværende anbefalinger til screening af atleter vægt på foranstaltninger til at opdage hypertrofisk kardiomyopati.
Hypertrofisk kardiomyopati er den mest almindelige årsag til pludselig hjertedød blandt atleter og en af de mest almindelige årsager til pludselig hjertedød blandt unge mennesker.
Ekkokardiografi ved hypertrofisk kardiomyopati (HCM)
Hypertrofien er generelt asymmetrisk, dvs. at dens fordeling i venstre ventrikels myokardium varierer. Septal hypertrofi, apikal hypertrofi og hypertrofi af det frie væg i venstre ventrikel er almindelige. Generel hypertrofi er mindre almindelig.
Hypertrofisk kardiomyopati forårsager koncentrisk hypertrofi
Hypertrofisk kardiomyopati forårsager koncentrisk hypertrofi, hvilket betyder, at det genererede myokardium fordeler pladsen i det ventrikulære hulrum. Ved koncentrisk hypertrofi reduceres venstre ventrikels volumen, hvilket betyder, at ejektionsfraktionen (EF) skal øges for at producere tilstrækkelige slagvolumener (figur 1). Selvom ventrikelvolumen er reduceret ved koncentrisk hypertrofi, kan det stadig være normalt sammenlignet med referenceværdier.
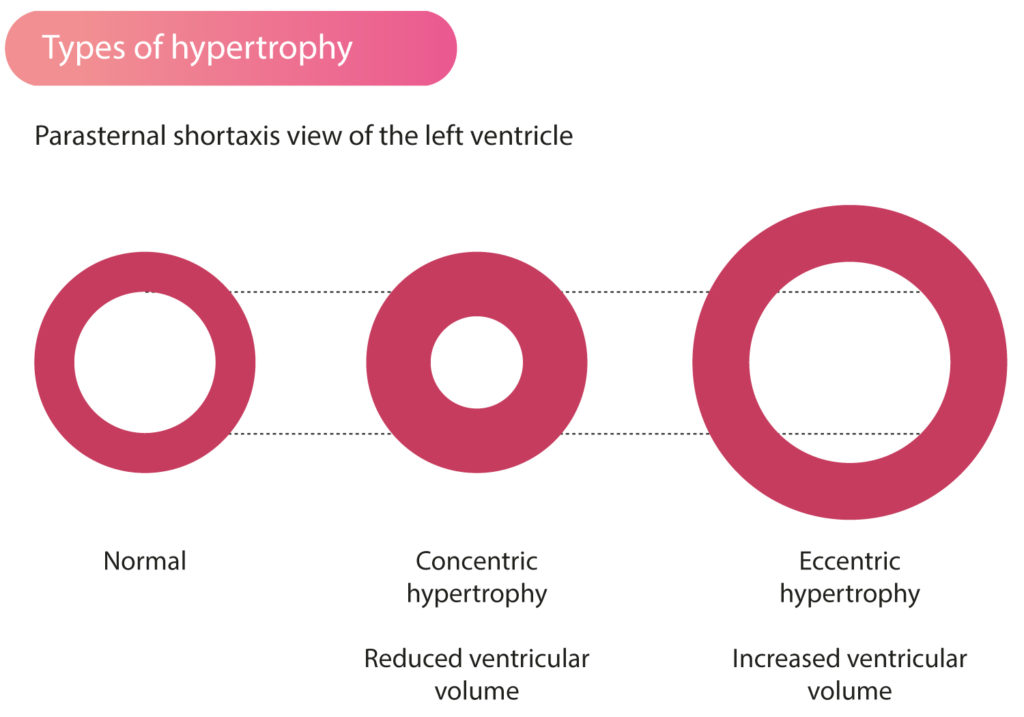
Det modsatte af koncentrisk hypertrofi er excentrisk hypertrofi, som er almindelig blandt atleter. Excentrisk hypertrofi er kendetegnet ved hypertrofi af de ydre myokardielag, som ikke reducerer venstre ventrikels volumen. Atleter udviser typisk øget ventrikelvolumen og let reduceret ejektionsfraktion. Atletens hjerte er i stand til at opretholde hjertets output ved lavere ejektionsfraktioner på grund af det faktum, at de genererer store slagvolumener.
Definition af hypertrofisk kardiomyopati
For at diagnosticere hypertrofisk kardiomyopati foretages følgende to målinger i det parasternale langaksebillede (PLAX) eller det parasternale kortaksebillede (PSAX):
- Septal tykkelse
- Tykkelse af den inferolaterale væg
Hvis en af dem overstiger 15 mm, er der tale om hypertrofi. Hvis hypertrofien ikke i tilstrækkelig grad kan forklares med hypertension eller aortastenose, er der sandsynligvis tale om hypertrofisk kardiomyopati.
Atleter udviser ofte udtalt fysiologisk hypertrofi, som kan være svær at skelne fra kardiomyopati. Ligeledes kan lagringsforstyrrelser og mitokondriesygdomme forårsage vægfortykkelse, hvilket kan være vanskeligt at skelne fra hypertrofisk kardiomyopati. Følgende træk kan bruges til at skelne kardiomyopati fra differentialdiagnoserne:
- En hyperdynamisk venstre ventrikel tyder på kardiomyopati.
- Alvorlig septumhypertrofi tyder på kardiomyopati.
- Obstruktion i LVOT tyder på kardiomyopati.
- En lille venstre ventrikel tyder på kardiomyopati.
Tabel 1 viser en omfattende liste over tilstande, der kan efterligne HCM/HOCM (tilpasset fra Marian et al [1]).
Tabel 1. Fænokopitilstande for hypertrofisk kardiomyopati
| Fænotype | Fænotypisk ledetråd |
| AMPK-medieret glykogenlagring | Normal eller reduceret systolisk funktion i venstre ventrikel, præ-eksitationsmønster |
| Pompes sygdom | Autosomal recessiv, multiorgansygdom, præ-excitationsmønster |
| Anderson-Fabrys sygdom | X-bundet, multisystem, der også involverer hud, nyrer og perifere nerver |
| Danmarks sygdom | X-bundet dominant, proksimal muskelsvaghed, intellektuel funktionsnedsættelse, kort PR på EKG, forhøjede CK-niveauer |
| Amyloidose | Lav QRS-spænding, involvering af andre organer, subendotelial LGE |
| Kearns-Sayre syndrom | Multisystemisk sygdom |
| Friedreichs ataksi | Autosomal recessiv, neurodegeneration |
| Myotonisk dystrofi | Myotoni, muskeldystrofi, grå stær og skaldethed i panden |
| Noonan/LEOPARD-syndromer (rasopatier) | Medfødte hjertefejl defekter, lentiginer, Café-au-lait-pletter |
| Neimann-Pick sygdom | Autosomal recessiv neurodegenerativ sygdom |
| Refsums sygdom | Retinitis pigmentosa, perifer neuropati og ataksi |
| Døvhed | Autosomal dominant døvhed |
CK = kreatinkinase; LGE sen gadoliniumforstærkning.
Hypertrofisk obstruktiv kardiomyopati (HOCM)
Ved hypertrofisk kardiomyopati er det vigtigt at afklare, om hypertrofien forårsager en forsnævring af den venstre ventrikels udstrømningskanal (LVOT). Ca. 65 % af patienter med hypertrofisk kardiomyopati har obstruktion i LVOT, en tilstand, der kaldes hypertrofisk obstruktiv kardiomyopati (HOCM).
HOCM med systolisk anterior bevægelse (SAM)
Obstruktionen i LVOT er forårsaget af septumhypertrofi. Når septum buler ind i LVOT, ændres hæmodynamikken i udstrømningskanalen, hvilket fører til, at mitralklappens forreste folder suges ind i LVOT. Resultatet er, at udstrømningskanalen bliver obstrueret. Bevægelsen af mitralklappens forreste folder kaldes systolisk anterior bevægelse (SAM). Obstruktion af LVOT skyldes således hypertrofi af septum og efterfølgende SAM (figur 2).
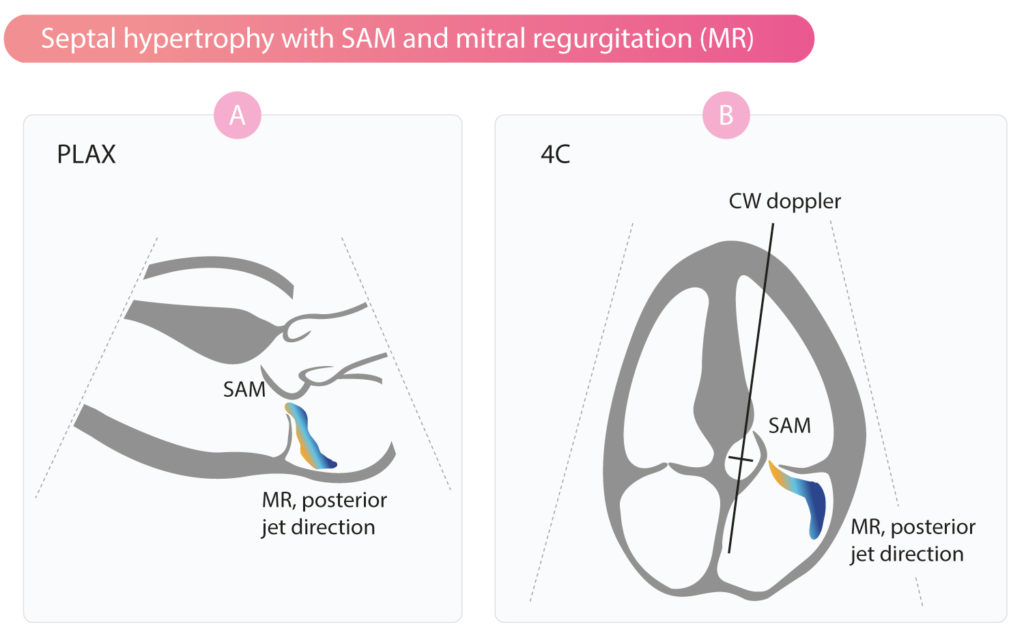
Hvis SAM er udtalt, kan den forreste folder røre ved septum under systolen. Efterfølgende kan en udtalt obstruktion føre til lukning eller flagren af aortaklappen under systolen.
Mitralregurgitation er et biprodukt af SAM (figur 2).

Kontinuerlig bølgedoppler (CW) bruges til at påvise obstruktion i LVOT (figur 2 og 3). Spektralkurven er kendetegnet ved en langsom acceleration, som adskiller den fra dopplersignalet ved aortastenose (figur 3).
Bemærk, at SAM typisk får mitralklappens regurgitationsstråle til at involvere LVOT. Det er vigtigt at placere Doppler-markøren korrekt i LVOT for at undgå utilsigtet registrering af mitralklapregurgitationsstrålen. Video 1 viser HOCM med SAM.
Obstruktion i LVOT påvirkes af fyldningen af venstre ventrikel. Jo mindre fyldning, jo mere udtalt er obstruktionen. Det betyder, at hypovolæmi og takykardi (som begge fører til nedsat ventrikelfyldning) forårsager øget obstruktion i LVOT. Valsalva-manøvren reducerer også venstre ventrikels fyldning (obstruktion i LVOT kan fremkaldes ved at udføre Valsalva-manøvren).
SAM forårsager mitral regurgitation (MR)
Som nævnt ovenfor er hypertrofisk kardiomyopati med SAM generelt ledsaget af mitralklapregurgitation (MR) med en bagudrettet stråle.
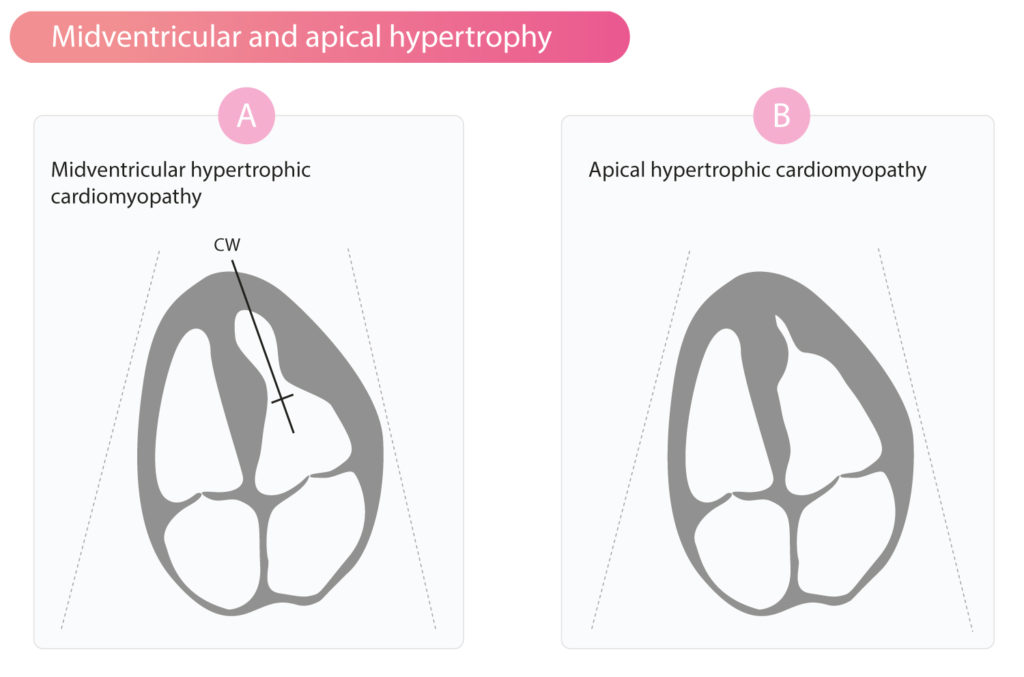
Apikal og midtventrikulær hypertrofi
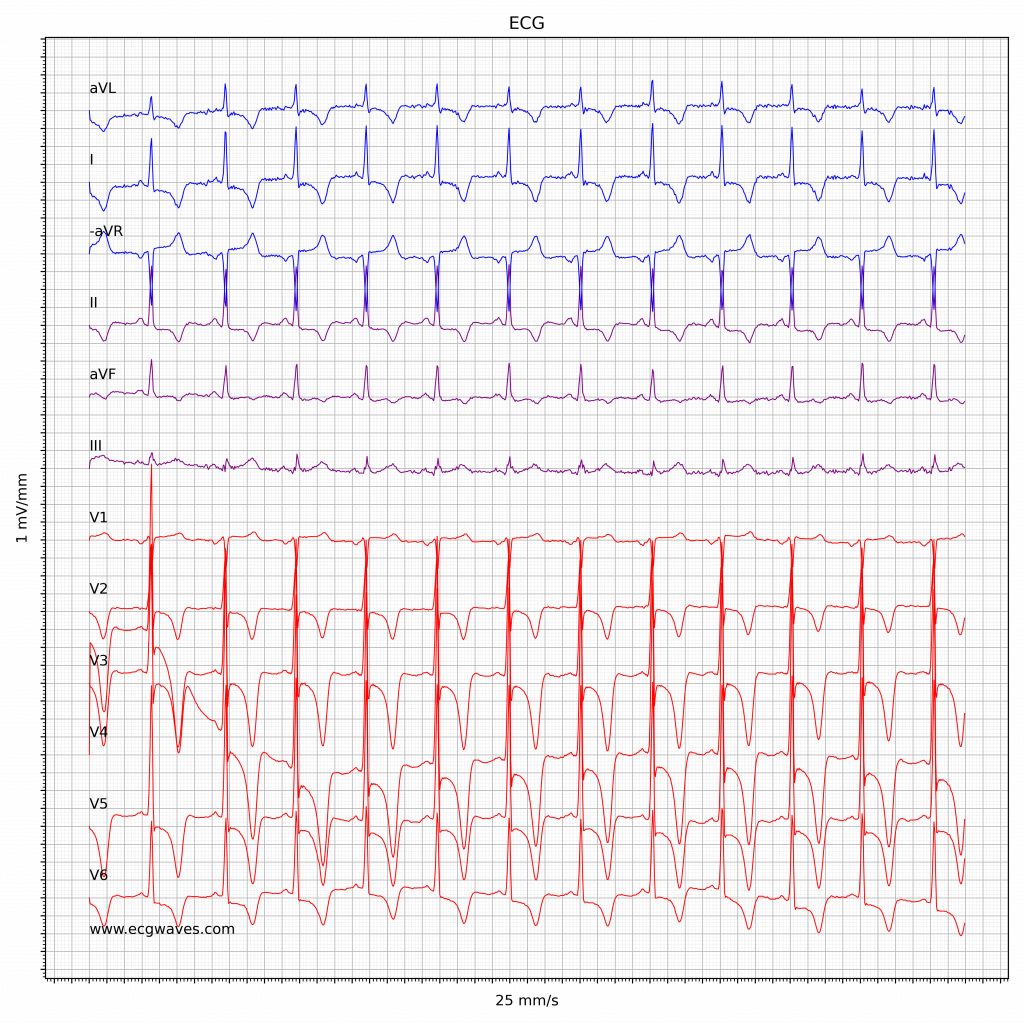
Ved midtventrikulær hypertrofi kan der observeres obstruktion midt i ventriklen, hvilket opdages ved hjælp af continuous wave (CW) Doppler (Figur 4A). Ved apikal hypertrofi ses fyrretykket myokardium i apex. Dette giver hulrummet et spidst udseende, som vist i figur 4B. Patienter med apikal hypertrofisk kardiomyopati udviser T-bølgeinversion i de prækordiale afledninger (V1-V6) på EKG.
Diastolisk funktion ved hypertrofisk kardiomyopati
Hypertrofisk kardiomyopati fører til nedsat diastolisk funktion, dvs. at afslapningen af venstre ventrikel er nedsat, hvilket resulterer i forlænget decelerationstid (DT) og reduceret E/A-ratio. Decelerationstiden er forlænget, fordi det tager længere tid at udligne trykforskellen mellem venstre atrium og ventrikel. Dette forklares med, at venstre ventrikels compliance er reduceret ved hypertrofisk kardiomyopati.
Pludselig hjertedød (SCD) ved hypertrofisk kardiomyopati
Hypertrofisk kardiomyopati er en af de mest almindelige årsager til pludseligt hjertestop blandt unge mennesker. Hjertestop kan ramme enhver person med hypertrofisk kardiomyopati. Det skal dog bemærkes, at forekomsten af pludseligt hjertestop er meget lav blandt personer med HCM/HOCM.
Patienter med hypertrofisk kardiomyopati, som har oplevet kredsløbsstop eller maligne ventrikulære arytmier, vil sandsynligvis ikke have gavn af betablokkere eller antiarytmika. Den mest effektive behandling er en ICD (Implantable Cardioverter Defibrillator). Tabel 2 viser risikofaktorer for hjertestop ved hypertrofisk kardiomyopati.
Tabel 2. Risikofaktorer for pludseligt hjertestop ved kardiomyopati
| Kendte risikofaktorer |
| Tidligere hjertestop (“aborteret SCD”) |
| Familiehistorie med pludseligt hjertestop |
| Tidligere synkope |
| Historie af ventrikulær takykardi |
| Alvorlig hypertrofi |
| Sandsynlige risikofaktorer |
| LVOT-obstruktion |
| Unormal blodtryksreaktion under træning |
| Tidlig debut af symptomer |
Faldgruber
SAM forekommer også hos personer, der ikke har HOCM. Personer, der har venstre ventrikelhypertrofi, kan udvikle SAM i forbindelse med hypovolæmi.
Nedenfor følger supplerende materiale beregnet på læsere, der er interesserede i de gener, der forårsager HCM. Der henvises til Marian et al. for detaljer (1).
Etablerede kausale gener for HCM
Etableret kausalt gen for HCM (store familier)
| Gen | Protein | Funktion |
| MYH7 | β-Myosin tung kæde | ATPase-aktivitet, kraftgenerering |
| MYBPC3 | Myosin-bindende protein C | Sammentrækning af hjertet |
| TNNT2 | Hjerte troponin T | Regulator af aktomyosin-interaktion |
| TNNI3 | Hjerte troponin I | Hæmmer af aktomyosin-interaktion |
| TPM1 | α-Tropomyosin | Placerer troponinkomplekset på hjertets aktin |
| ACTC1 | Hjerte α-aktin | Aktomyosin interaktion |
| MYL2 | Regulatorisk myosin let kæde | Myosin tung kæde 7-bindende protein |
| MYL3 | Essentielt myosin let kæde | Myosin tung kæde 7-bindende protein |
| CSRP3 | Cystein- og glycinrigt protein 3 | Muskel-LIM-protein (MLP), et Z-diskprotein |
Sandsynligvis kausal gener for HCM (små familier)
| Gen | Protein | Funktion |
| FHL1 | Ild og en halv LIM-domæner 1 | Muskeludvikling og hypertrofi |
| MYOZ2 | Myozenin 2 (calsarcin 1) | Z-diskprotein |
| PLN | Fosfolamban | Regulator af sarkoplasmatisk retikulum-calcium |
| TCAP | Tcap (telethonin) | Titin-kapprotein |
| TRIM63 | Muskel-ringfinger-protein 1 | E3-ligase af proteasom ubiquitin-system |
| TTN | Titin | Sarkomer-funktion |
Generelt forbundet med HCM (små familier og sporadiske tilfælde)
| ACTN2 | Aktinin, α2 | Z-skiveprotein |
| ANKRD1 | Ankyrin gentagelsesdomæne 1 | En negativ regulator af hjertets gener |
| CASQ2 | Calsequestrin 2 | Calcium-bindende protein |
| CAV3 | Caveolin 3 | Et caveolae-protein |
| JPH2 | Junctophilin-2 | Intracellulær calcium-signalering |
| LDB3 | Lim-domænebinding 3 | Z-diskprotein |
| MYH6 | Myosin tung kæde α | Sarkomer protein udtrykt i lave niveauer i det voksne menneskehjerte |
| MYLK2 | Myosin let kæde kinase 2 | Fosforylerer myosins lette kæde 2 |
| NEXN | Nexilin | Z-skiveprotein |
| TNNC1 | Hjertetroponin C | Calcium-følsom regulator af myofilamentfunktion |
| VCL | Vinculin | Z-diskprotein |
Referencer
