Principper for hjertets elektrofysiologi og elektrokardiografi (EKG)
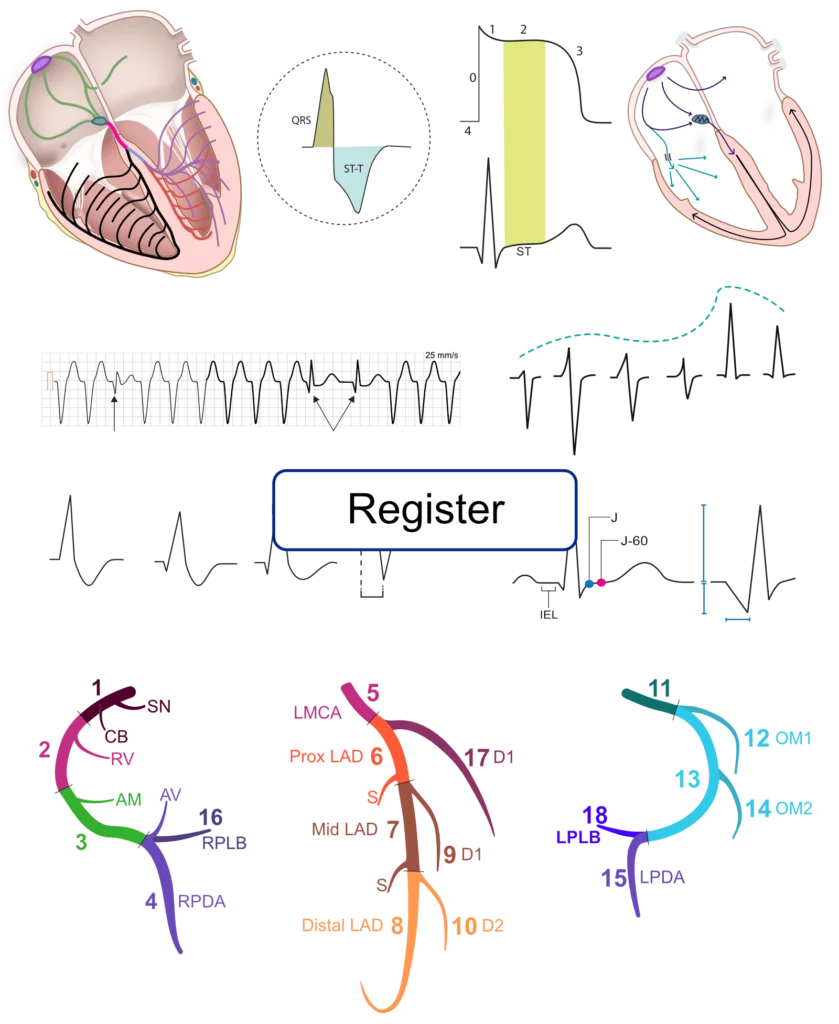
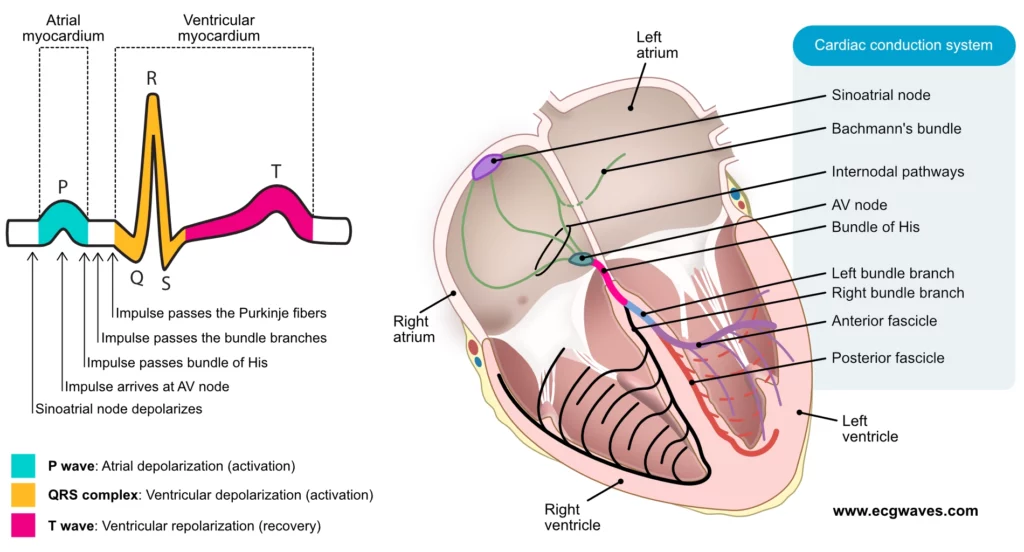
For at sikre en effektiv pumpefunktion i hjertet skal atrierne og ventriklerne aktiveres hurtigt og sekventielt. Hurtig aktivering er vigtig for at aktivere så meget myokardium samtidig som muligt; jo mere myokardium, der trækker sig sammen på samme tid, desto mere effektiv er pumpemekanismen. Sekventiel aktivering indebærer, at forkamrene aktiveres først, og at de fylder hjertekamrene med tilstrækkelige mængder blod, før sammentrækningen af hjertekamrene påbegyndes. For at koordinere disse to opgaver har hjertet et elektrisk ledningssystem, der består af specialiserede myokardieceller (herefter kaldet ledningsceller). Disse celler danner bundter af fibre, der fungerer som elektriske ledninger, der spreder aktionspotentialet hurtigt og sekventielt til det kontraktile myokardium i atrierne og ventriklerne. Når det kontraktile myokardium modtager aktionspotentialet, aktiveres det og trækker sig sammen. Figur 1 illustrerer de relevante komponenter i ledningssystemet, hjertet og de klassiske EKG-bølgeformer.
Celletyper i elektrokardiologi
I forbindelse med denne diskussion er det vigtigt at skelne mellem hovedtyper af hjerteceller:
- Ledningsceller danner de fibernetværk, der vokser ind i myokardiet og spreder aktionspotentialet. Disse celler har stort set ingen kontraktil funktion.
- Kontraktile myokardieceller udfører den faktiske sammentrækning, men er også i stand til at overføre aktionspotentialet, om end med en meget lavere hastighed end ledningscellerne. Udtrykkene kontraktilt myokardium, myokardium eller blot myokardiecelle henviser til denne celletype, og disse udtryk bruges i flæng.
Hjertets cellearkitektur
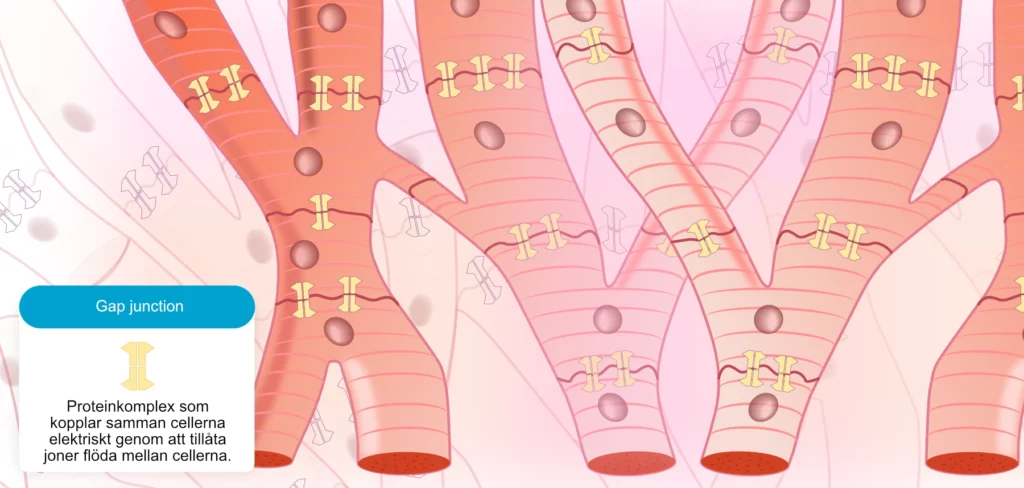
I modsætning til skeletmuskulaturen har hjertecellerne en grenlignende morfologi. Som illustreret i figur 2 er alle hjerteceller forbundet, både elektrisk og mekanisk, langs deres lange akse. Denne cellearkitektur kalder et syncytium, hvilket betyder, at hele netværket af celler fungerer som én enhed. Det betyder, at hvis en celle i syncytiummet aktiveres, vil den aktivere alle celler nedstrøms (forudsat at de er exciterbare). Forbindelserne mellem cellerne kaldes interkalerede skiver. Den interkalerede skive består af cellemembranproteiner, der forbinder tilstødende celler både mekanisk og elektrisk. Den elektriske forbindelse etableres af gap junctions, som er proteiner, der danner kanaler mellem cellemembranerne. Elektrisk ladede ioner kan strømme mellem cellerne gennem gap junctions. Det betyder, at aktionspotentialet kan sprede sig fra en celle til den næste ad denne vej.
Hjertets aktionspotentiale
Aktionspotentialet omfatter en depolarisering (aktivering) efterfulgt af en repolarisering (genopretning). Som nævnt ovenfor starter hjertets cyklus, når sinoatrialknuden udleder det første aktionspotentiale, som derefter spreder sig gennem myokardiet som en bølgefront i vand. Specifikke ionkanaler på cellemembranerne åbner og lukker under de- og repolarisering, så ioner (Na [natrium], K [kalium], Ca2[ calcium]) kan strømme mellem det intra- og ekstracellulære rum. Aktionspotentialet involverer således bevægelse af ioner – som er ladede partikler – og derfor genererer aktionspotentialet en elektrisk strøm. Figur 3 (nedenfor) viser, hvordan aktionspotentialet ser ud i myokardieceller (aktionspotentialet vil blive diskuteret i detaljer i næste artikel).
Udtrykkene elektrisk impuls, impuls og impulsbølge bruges i flæng om den bølgelignende udbredelse af aktionspotentialet i myokardiet.
Hjertets elektromekaniske kobling
Depolarisering aktiverer myokardiecellerne og fremkalder cellulære processer, der fører til cellesammentrækning. Udbredelsen af en elektrisk impuls er derfor direkte koblet til en mekanisk begivenhed (dette kaldes elektromekanisk kobling). Fordi der er en overflod af ioner i vævene og væskerne omkring hjertet – og faktisk i hele menneskekroppen – overføres de elektriske strømme, der genereres i hjertet, hele vejen til huden, hvor de kan registreres ved hjælp af elektroder. Elektrokardiografi er kunsten at registrere og fortolke de elektriske potentialer, der genereres i myokardiet. Elektrokardiografen præsenterer disse elektriske hændelser i et diagram, der kaldes et elektrokardiogram (EKG).
De elektriske potentialer, der genereres af komponenter i ledningssystemet (sinoatrialknude, atrioventrikulærknude, His-bundt, Purkinje-fibre), er for små til at kunne registreres ved hjælp af overfladeelektroder (hud). Derfor viser EKG’et kun aktiviteten i det kontraktile atriale og ventrikulære myokardium. Det er uheldigt, fordi ledningssystemet spiller en afgørende rolle for hjertets funktion og ikke mindst for tolkningen af EKG’et. Heldigvis er det næsten altid muligt at drage konklusioner om ledningssystemet baseret på de synlige EKG-bølgeformer og rytmer. I nogle tilfælde er det dog nødvendigt med invasive elektrofysiologiske undersøgelser (optagelse af elektrisk aktivitet inde fra hjertet ved hjælp af katetre udstyret med elektroder).
Det elektriske ledningssystem i hjertet
Den sinoatriale knude (SA-knuden)
Den sinoatriale knude er en lille oval struktur, der ligger nær indgangen til vena cava superior i højre atrium (Figur 1). Sinoatrialknuden består af højt specialiserede celler med en udpræget evne til at depolarisere spontant uden at blive stimuleret. Cellerne i sinoatrialknuden er således i stand til spontant at udløse et aktionspotentiale. Denne evne til at depolarisere spontant kaldes automatik. Cellerne i sinoatrialknuden har en iboende depolariseringshastighed (frekvens) på ca. 70 gange i minuttet (hvilket resulterer i 70 hjerteslag i minuttet). Sinoatrialknuden omtales ofte som hjertets primære pacemaker.
Hastigheden af den spontane depolarisering i sinoatrialknuden ændres af det autonome nervesystem. Sympatisk stimulering øger frekvensen, mens parasympatisk stimulering sænker frekvensen. Derfor stiger hjertefrekvensen, når den sympatiske tone øges, og hjertefrekvensen falder, når den parasympatiske tone øges. Hjertefrekvensen på et givet tidspunkt afhænger af balancen mellem sympatisk og parasympatisk aktivitet. Sympatisk aktivitet dominerer under fysisk træning, mens parasympatisk aktivitet dominerer under hvile.
Sekundære (latente) pacemakere
Sinoatrialknuden er hjertets primære pacemaker. Der er dog yderligere strukturer, som har automatik og dermed evne til at fungere som hjertets pacemaker. Disse strukturer er som følger:
- Dele af det atriale myokardium: Der er klynger af atriale myokardieceller placeret omkring crista terminalis, indgangen til sinus coronarius og vena cava inferior samt celler omkring mitral- og tricuspidalklapperne, som besidder automatik. Disse celler er ikke ledningsceller i sig selv; de er kontraktile celler, der besidder automatik. Derfor er automatik ikke forbeholdt celler i ledningssystemet.
- Myokardiet omkring den atrioventrikulære (AV) knude: Det er en almindelig misforståelse, at den atrioventrikulære (AV) knude besidder automatik, fordi der ikke er noget overbevisende bevis for det. Der er dog tegn på, at celleklynger omkring AV-knuden besidder automatik. Denne automatik vil stadig – på trods af hvad der lige er blevet sagt – blive omtalt som AV-knudens automatik for at lette forståelsen.
- His-Purkinje-netværket: His-bundtet og hele Purkinje-netværket besidder automatik.
Den opmærksomme læser har måske bemærket, at det ventrikulære myokardium ikke besidder automatik, og det er vigtigt at bemærke, som vi skal se i senere kapitler.
Hjertet har altså fire pacemakere (den sinoatriale knude, dele af det atriale myokardium, myokardiet omkring AV-knuden og His-Purkinje-netværket). Grunden til, at sinoatrialknuden er den primære pacemaker, er, at den har den højeste intrinsiske rate af spontan depolarisering (dvs. den hurtigste automatik). Hjerterytmen styres af den hurtigste pacemaker (dvs. strukturen med den højeste hastighed af spontan depolarisering), fordi denne pacemaker depolariserer før de konkurrerende pacemakere og nulstiller dem, før de depolariserer.
Kliniske aspekter af automatik
Sinoatrialknuden kan blive dysfunktionel og undlade at depolarisere. Manglende depolarisering kan være intermitterende, vedvarende i længere perioder eller permanent. Dette kan potentielt resultere i hjertestop, men det sker sjældent, fordi fraværet af sinoatriale impulser vil gøre det muligt for en af de andre pacemakere at etablere en hjerterytme. Denne adfærd er grunden til, at de andre pacemakere ofte omtales som latente pacemakere. Den iboende hastighed af spontan depolarisering i de latente pacemakere er højest i det atriale myokardium og lavest i Purkinje-fibrene. Det ser således ud til, at automatikken falder gradvist med afstanden fra sinoatrialknuden. Det betyder, at hvis den sinoatriale knude ikke depolariserer, er det mest sandsynligt, at en røddende rytme vil blive etableret af det atriale myokardium. Hvis det atriale myokardium også svigter, er det mest sandsynligt, at cellerne omkring den atrioventrikulære knude vil overtage rytmen. Som en sidste udvej er der et omfattende netværk af Purkinje-fibre, der starter i His-bundtet, som kan etablere en rytme. Denne rækkefølge, fra sinoatrialknuden til purkinjefibrene, kaldes pacemakerhierarkiet. Figur 4 viser pacemakerhierarkiet.
Det skal bemærkes, at den automatik, der er omtalt ovenfor, er normal automatik, som kun forekommer i sinoatrialknuderne og de latente pacemakere. Der findes dog også unormal automatik, som kan opstå hvor som helst i hjertet, også i det ventrikulære myokardium. Dette diskuteres senere.
Impulsoverførsel (ledning, udbredelse)
Cellerne i ledningssystemet har stort set ingen kontraktil funktion. Ledningscellerne er blot ansvarlige for at sprede depolariseringen hurtigt og synkront til de kontraktile celler, så de kan trække sig sammen. Der er dog færre ledningsceller end kontraktile celler, hvilket betyder, at ledningscellerne kun kommunikerer med en del af det kontraktile myokardium. De resterende kontraktile celler, som ikke kommunikerer direkte med ledningscellerne, er afhængige af andre kontraktile celler for at få den elektriske impuls. Husk på, at alle celler i hjertet er forbundet, både mekanisk og elektrisk, og det gør det muligt for den elektriske impuls at sprede sig fra en celle til den næste. Impulsoverførslen mellem kontraktile myokardieceller er dog betydeligt langsommere end overførslen gennem ledningsfibrene.
Transmission af atrieimpulser
Ledningssystemet er vagt defineret i atrierne sammenlignet med ventriklerne, som har tydelige ledningsstrukturer som His-bundtet og bundtgrenene. Der er dog tre ret forskellige fiberbundter, som ser ud til at fungere som ledningssystem i atrierne. Disse bundter overfører atrieimpulsen med en hastighed på 1 m/s, og de kaldes de internodale baner. Et af disse er Bachmanns bundt, som leder impulsen fra højre til venstre atrium. Se figur 1 (ovenfor).
Det atrioventrikulære ledningssystem
Den atrioventrikulære knude (AV-knuden)
Den atrioventrikulære knude (AV-knuden) er broen mellem atrierne og ventriklerne. Den er placeret i atrieseptum og er normalt den eneste forbindelse mellem atrierne og ventriklerne (figur 1). AV-knuden modtager atrieimpulsen og forsinker den, før den ledes videre til ventriklerne. Forsinkelsen skyldes den langsomme ledning gennem den atrioventrikulære knude. Formålet med den langsomme ledning er at give atrierne tilstrækkelig tid til at fylde ventriklerne med blod, før ventrikelsammentrækningen begynder.
Bundtet af hans
Den atrioventrikulære knude fortsætter i His-bundtet, som deler sig i den venstre bundtgren og den højre bundtgren. Disse bundter forgrener sig successivt til finere bundter og i sidste ende Purkinje-fibre, som spirer ind i myokardiet. Bemærk, at den venstre bundtgren deler sig i en forreste og en bagerste fascikel.
Purkinje-fibrene
Impulsoverførslen i Purkinje-netværket er meget hurtig (4 m/s). Purkinje-fibrene løber hovedsageligt gennem endokardiet, hvor de leverer den depolariserende impuls til kontraktile myokardieceller. Nogle Purkinje-fibre strækker sig dybere ind i myokardiet (sjældent dybere end en tredjedel af væggens tykkelse). Det betyder, at aktivering af ventriklerne (undtagen septum) starter i endokardiet og bryder sig mod epikardiet (figur 5). Den hurtige impulsoverførsel i Purkinje-netværket gør det muligt at aktivere stort set hele det ventrikulære myokardium på samme tid. Som nævnt ovenfor, når impulsen leveres til de kontraktile myokardieceller, finder den efterfølgende impulsoverførsel sted fra en kontraktil celle til den næste, hvilket er meget langsommere (0,4 m/s).
Indflydelse fra det autonome nervesystem
Vagusnerven forsyner hjertet med parasympatiske fibre. Disse fibre innerverer primært den sinoatriale knude og den atrioventrikulære knude. Øget vagal tone fører til langsommere automatik i sinoatrialknuden og langsommere ledning gennem atrioventrikulærknuden. Dette fører til en lavere hjertefrekvens (og en ubetydelig stigning i forsinkelsen i den atrioventrikulære knude). Intensiv vagal aktivitet kan hæmme sinoatrial aktivitet i en sådan grad, at der ikke genereres nogen impulser, og det kan føre til synkope (besvimelse). Som beskrevet ovenfor vil latente pacemakere vågne og overtage genereringen af aktionspotentialer, indtil sinoatrialknuden kommer sig.
Sympatiske fibre innerverer hele hjertet, både ledningssystemet og det kontraktile myokardium. Fibrene løber langs blodkarrene og er særligt tætte i det ventrikulære myokardium. Sympatisk stimulering fører til øget excitabilitet i alle celler. Det betyder, at øget sympatisk aktivitet resulterer i øget hjertefrekvens (ved at øge automatikken i sinoatrialknuden), øget kontraktil kraft og øget hastighed af impulsledning.
Definition af hjerterytme
En rytme defineres som tre på hinanden følgende hjerteslag, der viser (mere eller mindre) identiske bølgeformer på EKG’et. Ligheden mellem bølgeformerne indikerer, at deres oprindelse er den samme. Sinoatrialknuden er hjertets pacemaker under normale omstændigheder, og rytmen kaldes sinusrytme. Selvom det ikke er muligt at se de elektriske potentialer i selve sinoatrialknuden, er der indirekte beviser fra EKG’et, som bekræfter rytmens oprindelse (diskuteres senere).
Hvis en struktur uden for sinoatrialknuden udleder et aktionspotentiale, der resulterer i myokardie-depolarisering, betegnes denne struktur som ektopisk fokus, og slaget kaldes et ektopisk slag. En ektopisk rytme opstår, når tre eller flere på hinanden følgende hjerteslag stammer fra et ektopisk fokus. Hvis en ektopisk rytme er en erstatning for den normale sinusrytme, kaldes den en escape-rytme . Disse emner vil blive diskuteret i detaljer senere.
Konklusion
Hjertecyklussen begynder, når sinoatrialknuden udleder et aktionspotentiale, som spredes gennem hjertet. Aktionspotentialet spredes i form af en elektrisk impuls ved celle-til-celle-transmission af depolariseringen. Impulsen spredes via de internodale baner og Bachmanns bundt i atrierne. Derefter forsinkes den kortvarigt i den atrioventrikulære knude, før den hurtigt spredes – via His-Purkinje-netværket – gennem det ventrikulære myokardium. Sammentrækningen starter, når de kontraktile celler modtager impulser.
Aktionspotentialet består af depolarisering (aktivering) og repolarisering (genopretning). Denne proces omfatter hurtige ændringer i membranpotentialet, som er en konsekvens af, at der strømmer ioner over cellemembranen. Strømmen af ioner er lig med en elektrisk strøm, og den elektriske aktivitet i det atriale og ventrikulære myokardium registreres og analyseres af elektroder, der er placeret på huden. EKG-tolkning handler om at dechifrere disse elektriske strømme.
Interesserede læsere kan studere Wiggers-diagrammet nedenfor. Det viser sammenhængen mellem EKG, tryk og volumen i hjertet i løbet af hjertecyklussen.