Medfødt hjertesygdom & GUCH (Grown Up Congenital Heart disease)
Ekkokardiografi ved medfødt hjertesygdom (CHD) og Grown Up Congenital Heart (GUCH)
Overlevelsen ved medfødt hjertesygdom (CHD) er steget dramatisk i løbet af de sidste par årtier. Det har resulteret i en øget forekomst af medfødt hjertesygdom i den almindelige befolkning, så de fleste klinikere jævnligt vil møde patienter med CHD. Omkring 95 % af alle tilfælde af medfødt hjertesygdom når voksenalderen (Mandalenakis et al.). Det største spring i overlevelse er observeret blandt tilfælde med de mest komplekse misdannelser. Faktisk er selv de mest alvorlige misdannelser blevet rutinepraksis. Behandlingsrepertoiret omfatter kirurgi, kateterindgreb og medicinsk behandling. Voksne med medfødt hjertesygdom behandles for det meste på GUCH-klinikker (Grown Up Congenital Heart disease).
Udbredelse af medfødt hjertesygdom (CHD)
Medfødt hjertesygdom (CHD) er den mest almindelige klasse af større medfødte misdannelser. CHD forekommer hos ca. 1 % af alle levendefødte og 10 % af alle aborterede fostre uden væsentlige geografiske variationer. Omkring 25 % af børn med medfødt hjertesygdom har brug for indgreb i løbet af deres første leveår (Triedman et al.).
Ifølge European Society for Cardiology har 2800 voksne pr. 1 million individer medfødte hjertefejl, og halvdelen af dem har moderate eller komplicerede defekter; den resterende tredjedel har milde defekter (Baumgartner et al ). Der fødes ca. 40.000 børn med CHD hvert år i USA (Triedman et al.).
Udbredelsen af medfødt hjertesygdom vil stige i takt med, at overlevelsen forlænges.
Neonatal screening med pulsoxymetri
Størstedelen af alle medfødte hjertefejl opdages tidligt i spædbarns- eller barndommen. Af indlysende grunde diagnosticeres mere komplekse defekter typisk tidligere. Defekter, der resulterer i nedsat iltmætning, opdages generelt med neonatal pulsoximetri (POX)-screening, som er rutine i alle vestlige lande. Ifølge et Cochrane-review vil der for hver 10.000 tilsyneladende sunde nyfødte børn være omkring seks, der har kritisk CHD, og pulsoxymetritesten vil korrekt identificere fem af disse med kritisk CHD (Plana et al). Mindre defekter kan gå ubemærket hen i mange år. Af og til kan større defekter gå ubemærket hen indtil voksenalderen.
Ekkokardiografi ved hjerte-kar-sygdom
Ekkokardiografi udføres på alle patienter med mistanke om hjerte-kar-sygdom. Ekkokardiografi giver detaljerede morfologiske og funktionelle oplysninger. Langt de fleste tilfælde kan karakteriseres ved hjælp af ekkokardiografi.
Sammenlignet med voksne personer kræver den ekkokardiografiske evaluering hos pædiatriske patienter en anden tilgang med mere vægt på hjertets position i brystkassen, den atriale situs viscerum, vene-atriale og atrio-ventrikulære forbindelser, forholdet mellem ventriklerne, den ventrikulo-arterielle forbindelse og forholdet mellem de store arterier (segmental analyse).
Ventrikelfunktionen evalueres ved hjælp af ejektionsfraktion, fraktioneret forkortelse, slagvolumen og myokardietykkelse. Strain imaging bruges også rutinemæssigt til at visualisere regional myokardiefunktion og -mekanik. Belastningsforhold og hjertefrekvens kan påvirke venstre ventrikels funktion.
Transøsofageal ekkokardiografi (TEE) er bedre end transthorakal ekkokardiografi (TTE), selv om sidstnævnte er den hyppigst anvendte metode.
Mange patienter kræver evaluering med yderligere modaliteter, f.eks. hjertemagnetisk resonansbilleddannelse (MRI), hjertecomputertomografi (CT), ergospirometri (anstrengelsestest) og hjertekateterisering.
Principper for behandling af medfødt hjertesygdom og GUCH
Komplekse misdannelser kræver ofte indgreb (kirurgisk eller kateterbaseret indgreb). Ud over misdannelsen udvikler disse personer ofte tilknyttede komplikationer, som kan kræve specifikke behandlinger. Sådanne komplikationer omfatter hjertesvigt, ventrikulære arytmier (f.eks. ventrikulær takykardi), supraventrikulære arytmier (f.eks. atrieflimren), pulmonal hypertension, arteriel (systemisk) hypertension, tromboembolisme og endokarditis. Håndtering af disse komplikationer følger konventionelle retningslinjer og principper. Desværre er der ikke udført randomiserede forsøg med disse patienter, hvilket forklarer, hvorfor de fleste anbefalinger er baseret på ekstrapolering af undersøgelser, der er udført på andre patientgrupper. For eksempel følger behandlingen af hjertesvigt ved CHD de samme principper som behandlingen af HFREF (hjertesvigt med reduceret ejektionsfraktion).
Arytmier er også almindelige blandt mennesker med medfødt hjertesygdom, selv efter korrektion af defekten. Da personer med GUCH ofte har nedsat hjertefunktion, kan selv milde arytmier forårsage dekompensation eller hæmodynamisk forværring.
Patienter med GUCH, som har haft pludselige synkoper, bør evalueres nøje, da de har en øget risiko for hjertestop og pludselig død. De misdannelser, der er forbundet med størst risiko, er Fallots tetralogi, transposition af de store arterier (TGA), CCTGA (kongenitalt korrigeret transposition af de store arterier), medfødt aortastenose og enkelt ventrikel (UVH, univentrikulært hjerte).
ASD (atrieseptumdefekt)
Atrieseptumdefekt (ASD) gør det muligt for blod at strømme fra venstre atrium til højre atrium. Trykket i venstre atrium er større end trykket i højre atrium, hvilket forklarer, hvorfor blodet strømmer fra venstre til højre. Shuntingen af blod fra venstre til højre resulterer i volumenoverbelastning i højre side og i sidste ende udvidelse af højre atrium og højre ventrikel. Tilstande, der fører til øget tryk i venstre side (hypertension, kardiomyopati, aortaregurgitation, aortastenose, mitralregurgitation, mitralstenose), kan øge shuntningen fra venstre til højre yderligere.
Volumenoverbelastning i højre ventrikel fører til udbuling af septum ind i venstre ventrikel. Dette giver venstre ventrikel et D-formet udseende i PSAX (parasternal kortaksevisning). Som følge af volumenoverbelastning øges højre ventrikels slagvolumen, hvilket fører til øget flow gennem lungekredsløbet. Med tiden har PVR (pulmonal vaskulær modstand) og trykket i lungearterien (PA) en tendens til at stige. Stigningen i PVR og PA-tryk kan resultere i, at trykket i højre side i sidste ende overstiger trykket i venstre side, hvilket fører til, at blodet shuntes fra højre til venstre. Shuntingen af deoxygeneret blod ind i venstre ventrikel resulterer i udviklingen af cyanose. Denne tilstand kaldes Eisenmengers syndrom.
Estimering af shuntstørrelse ved ASD
Shuntstørrelsen beregnes ved at estimere blodgennemstrømningen gennem lungekredsløbet og det systemiske kredsløb. Dette opnås ved at sammenligne højre og venstre ventrikels slagvolumen. Højre ventrikels slagvolumen beregnes med en pulsbølgedoppler placeret i lungetrompeten (truncus pulmonalis) eller RVOT. Venstre ventrikels slagvolumen beregnes med pulsbølgedoppleren placeret i LVOT.
Venstre ventrikels slagvolumen (SV):
SVLVOT = arealLVOT – VTILVOT
Højre ventrikels slaggevolumen (SV):
SVRVOT = arealRVOT – VTIRVOT
Shuntstørrelsen beregnes ved hjælp af følgende formel:
SVRVOT/SVLVOT
Hvis slaggevolumenet er henholdsvis 120 ml og 40 ml, beregnes shuntstørrelsen som:
120/40 = 3
Dette udtrykkes som en 3:1 shunt (“3 til 1 shunt“). Beregningen er usikker ved pulmonal regurgitation og aortaregurgitation, da disse tilstande gør beregningen af slagvolumen usikker.
Typer af atrieseptumdefekt (ASD)
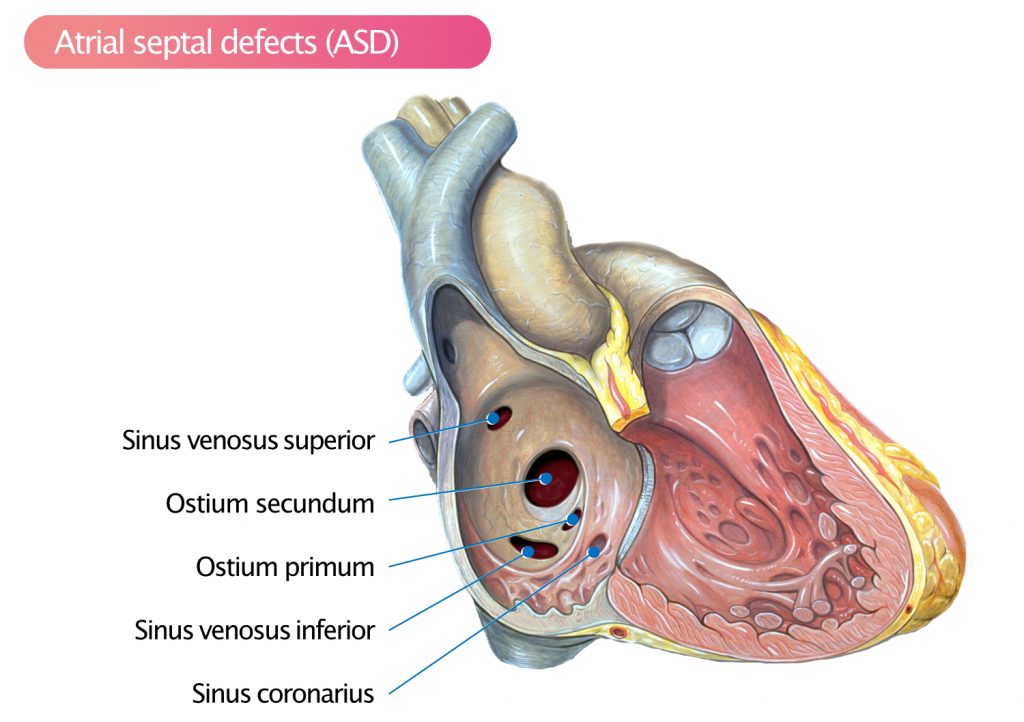
Atrieseptumdefekt (ASD) er – næst efter bikuspid aortaklap – den mest almindelige medfødte hjertefejl. ASD’er inddeles i fire typer (figur 1):
- Secundum-defekt (ostium secundum-defekt)
- Primum-defekt (ostium primum-defekt)
- Sinus venosus-defekt
- Defekt i sinus coronarius (sinus coronarius-defekt)
Secundum-defekt
Omkring 80 % af alle atrieseptumdefekter er secundumdefekter, som er placeret i fossa ovalis og dens omgivelser. Secundum-defekter omfatter defekter i foramen ovale. Der kan være flere secundum-defekter. Transthorakal ekkokardiografi (TTE) kan visualisere større ASD’er, men transøsofageal ekkokardiografi (TEE) er påkrævet i de fleste tilfælde.
Primum-defekt
Primum-defekter udgør 15 % af alle ASD’er. Disse defekter er placeret i den nedre del af atrieseptum nær det atrioventrikulære plan. Primumdefekter ledsages ofte af mitral- eller tricuspidalklapdefekter (typisk en spalte i mitralklappens forreste blad, som kan føre til mitralregurgitation). TEE er bedre end TTE til at visualisere primumdefekter.
Sinus venosus-defekt
Sinus venosus-defekter påvirker vena cava superior (5 %) eller vena cava inferior (< 1 %). Disse defekter kan føre til, at lungevenerne tømmer iltet blod ind i højre atrium eller i vena cava superior/inferior. TEE er nødvendig for at opdage denne defekt.
Defekt i sinus coronarius
Koronar sinusdefekt (< 1 %) er sjælden og ligger i koronar sinus ostium i højre atrium. I disse tilfælde mangler sinus coronarius et tag (“unroofed coronary sinus”), hvilket resulterer i en kommunikation mellem atrierne.
Prognose ved ASD
ASD er typisk asymptomatisk indtil voksenalderen. Efter 40-årsalderen har patienterne tendens til at udvikle tegn på højre hjertesvigt. Supraventrikulære arytmier (atrieflimren, atrieflagren) er almindelige. Alvorlig pulmonal hypertension rammer < 5 %. Paradoksale embolier forekommer, men er sandsynligvis mindre almindelige end embolier, der opstår i venstre atrial appendage under runder med atrieflimren.
Højre ventrikelbelastning (volumenbelastning) er det vigtigste fund ved ekkokardiografi.
Ventrikelseptumdefekt (VSD)
Ventrikelseptumdefekt (VSD) er almindelig og kan opdages i løbet af livet. Jo større defekten er, jo større er den hæmodynamiske påvirkning, og jo tidligere stilles diagnosen. De fleste defekter diagnosticeres i barndommen eller ungdommen. Defekter, der opdages i voksenalderen, er generelt mindre og forårsager sjældent hæmodynamiske effekter. De fleste VSD’er, der diagnosticeres i spædbarnsalderen, lukker sig spontant i løbet af det første leveår.
VSD kan eksistere isoleret eller i kombination med mere komplekse hjertefejl (f.eks. Fallots tetralogi, transposition af de store arterier osv.)
VSD fører til volumenbelastning af venstre ventrikel på trods af, at blodet shuntes fra venstre til højre ventrikel. Det antages, at dette skyldes, at højre ventrikel modtager det shuntede blod under systolen og formår at skubbe det ud i lungerne og videre til venstre atrium og ventrikel. Derfor fører VSD til overbelastning og dilatation af venstre ventrikel. Som ved ASD øges perfusionen gennem lungekredsløbet, hvilket kan føre til pulmonal hypertension. Med continuous wave doppler kan flowet gennem en VSD bruges til at beregne trykgradienten mellem ventriklerne.
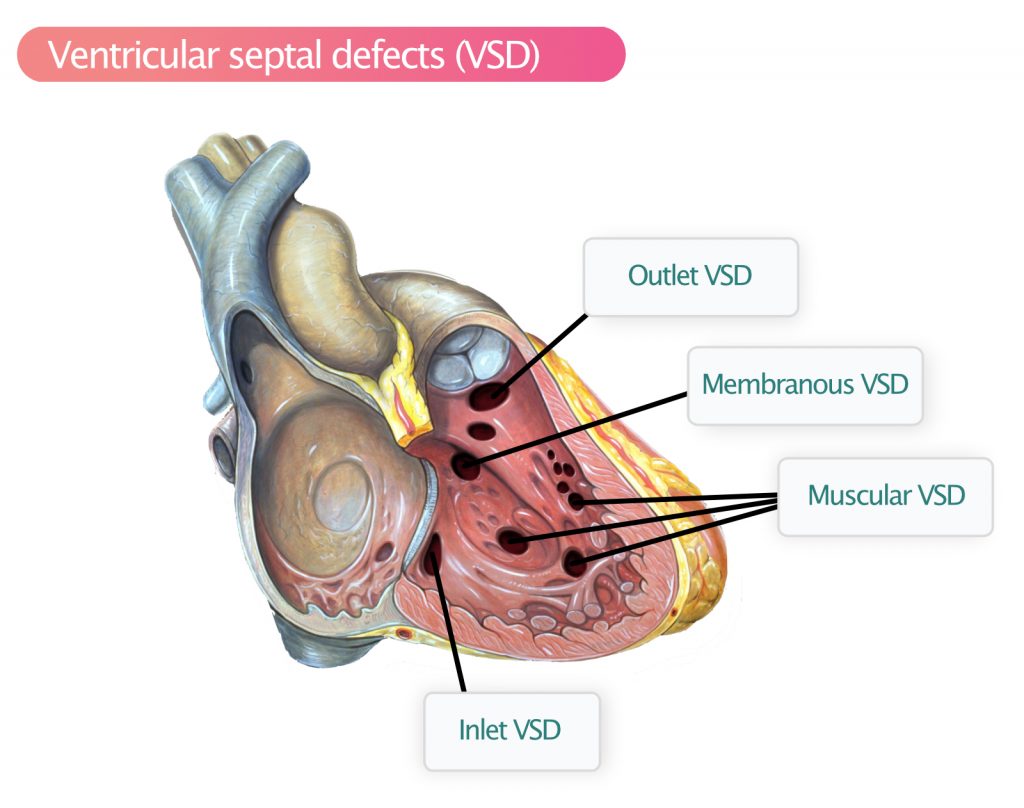
Baseret på placeringen af VSD’en defineres følgende typer (figur 2):
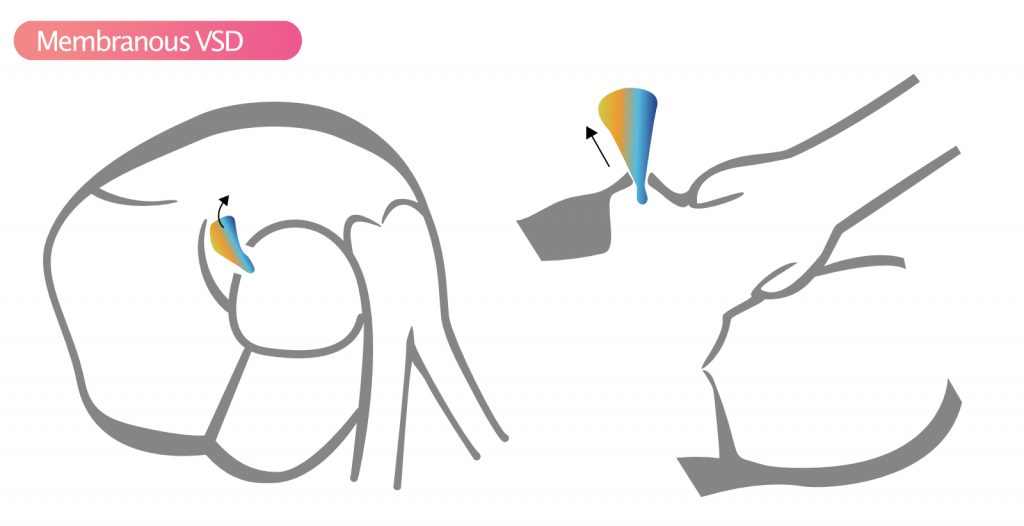
- Membranøs VSD – Den mest almindelige (80 %) type VSD. Den påvirker den membranøse del af septum interventricularis. Disse defekter ses bedst i parasternale billeder; især i SAX klokken 10. Spontan lukning er almindelig. I tilfælde af spontan lukning kan der udvikles en aneurisme. Sameksisterende aortaregurgitation er almindelig.
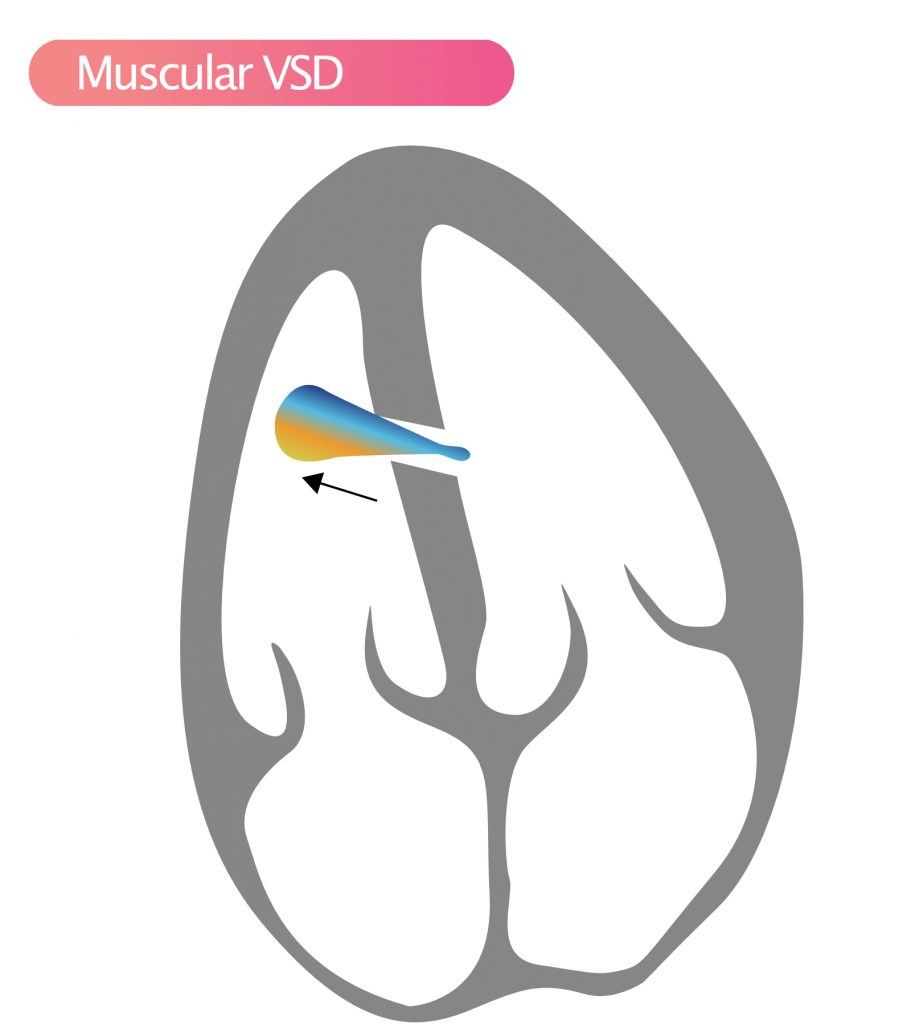
- Muskulær VSD (15 %) – Muskulære VSD’er kan findes overalt i septums muskulære segmenter. Der kan være flere defekter. Spontan lukning er meget almindelig. Muskulær VSD kan ses i apikal fire-kammer-visning (A4C) og kort-akse-visning (SAX).
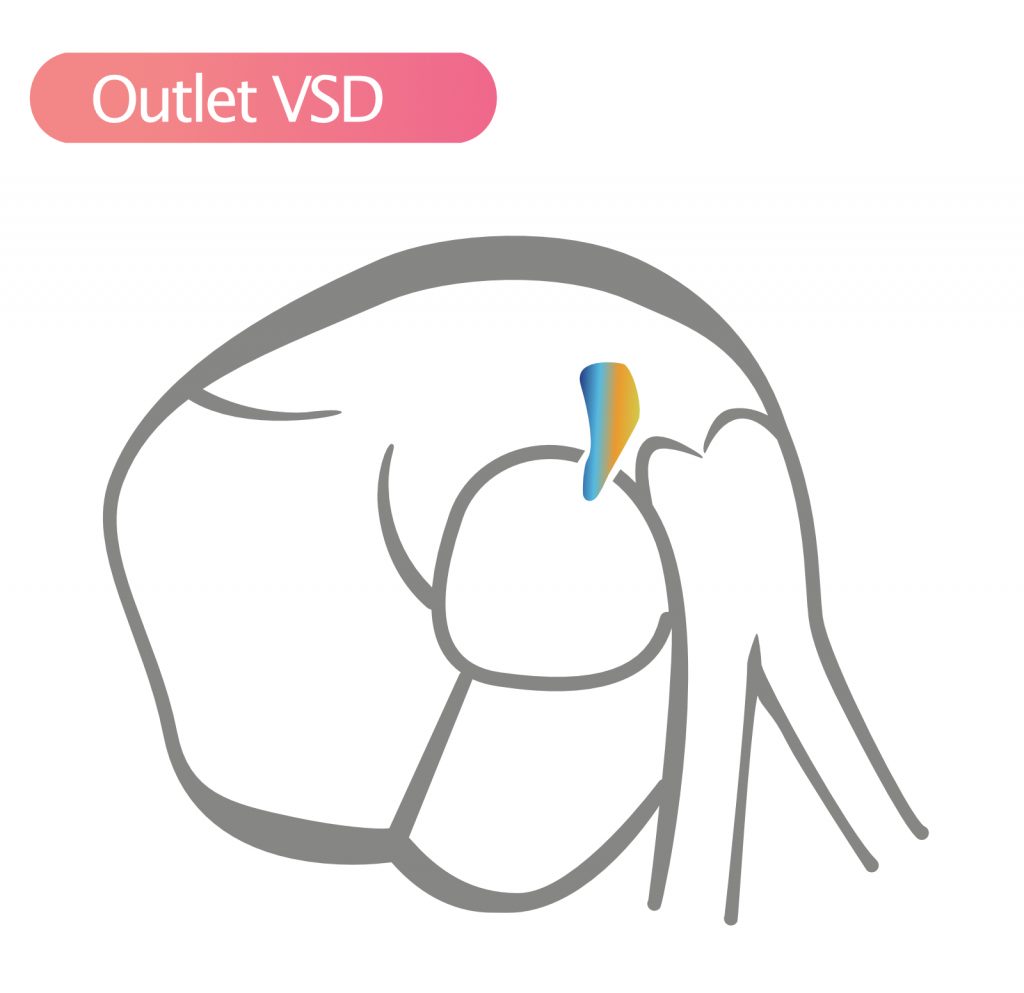
- Udløbs-VSD (5%) – Denne VSD ses i SAX-visning og er lokaliseret klokken 2, under væggen af aortaklappen og pulmonalklappen. Støtten til aortaklappen er forringet med risiko for aortaregurgitation. Spontan lukning er mindre almindelig.
- Inlet VSD (< 1 %) – Inflow VSD er lokaliseret i indløbet af septum. Det er typisk ved Downs syndrom, og defekten er ofte stor. Spontan lukning er mindre almindelig.
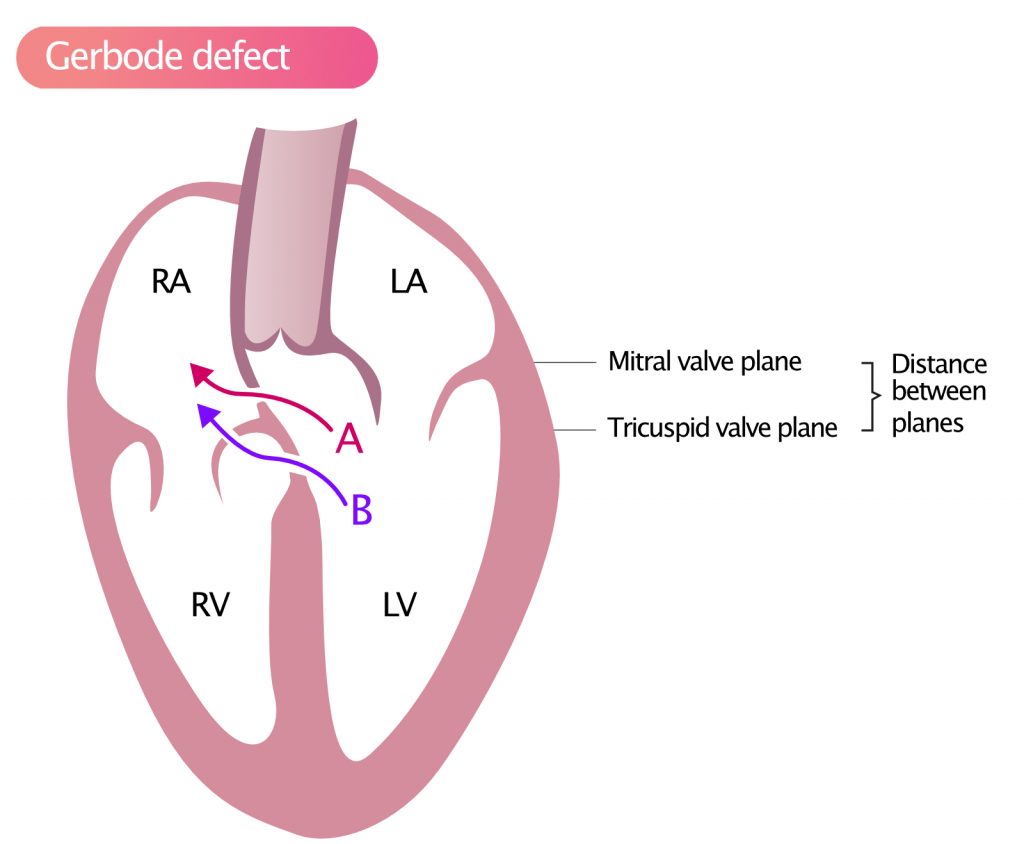
Gerbode-defekt
Da tricuspidalklappen er mere apikal end mitralklappen, kan en VSD forårsage shuntning af blod fra venstre ventrikel til højre atrium, som vist i figur 6. Denne type defekt kaldes Gerbode-defekt.
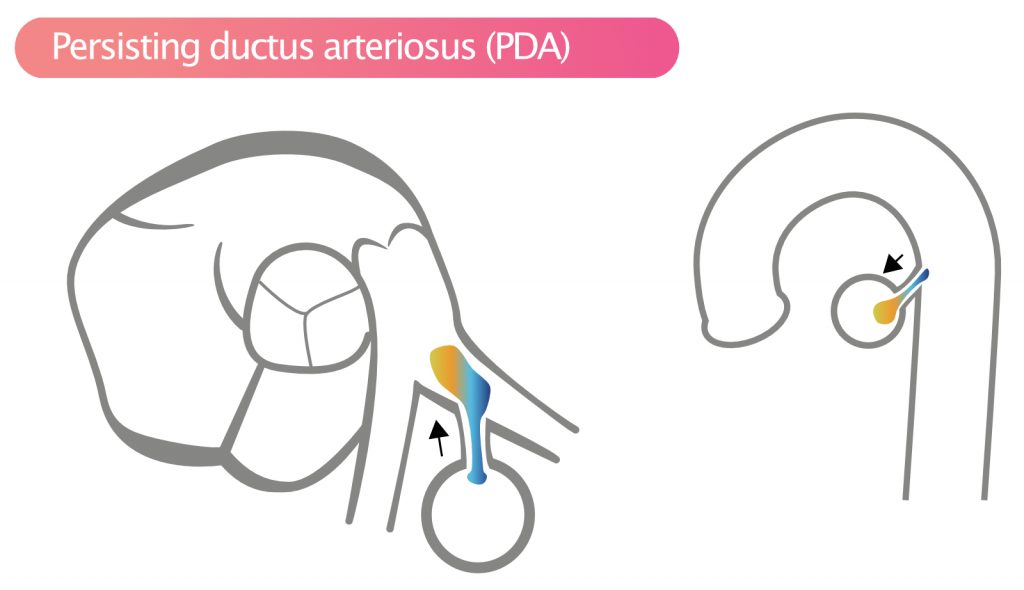
Persisterende ductus arteriosus (PDA)
Ductus arter iosus er forbundet i fosterlivet mellem lungepulsåren og den nedadgående aorta. Persisterende ductus arteriosus (PDA) betyder, at denne forbindelse ikke lukker sig efter fødslen. PDA er sjælden i voksenalderen. Defekten fører til volumenbelastning af venstre ventrikel og risiko for udvikling af pulmonal hypertension. PDA ses bedst med farvedoppler i suprasternal view eller short-axis view (SAX). Billedet skal fokusere på lungestammen og bifurkationen. Blodgennemstrømningen gennem PDA går fra aorta til lungestammen.
Coarctatio aortae (CA)
Coarctatio aortae betyder, at der er en forsnævring langs aorta, og denne forsnævring er oftest placeret langs den nedadgående aorta, hvilket er grunden til, at den kan visualiseres fra det suprasternale syn. Farvedoppler afslører turbulent flow, og kontinuerlig bølgedoppler afslører øgede hastigheder.

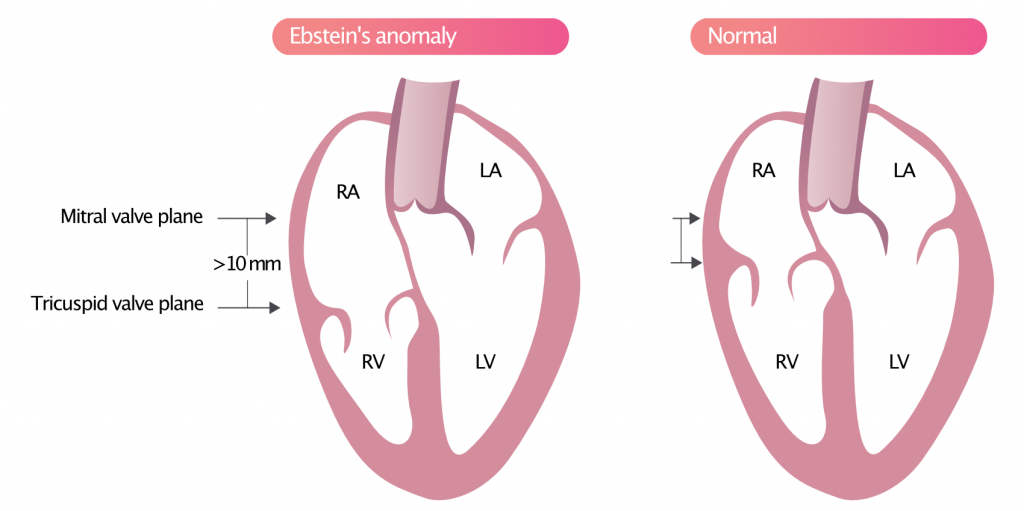
Ebsteins anomali
Normalt er tricuspidalklappen mere apikalt placeret end mitralklappen. Ebsteins anomali indebærer, at tricuspidalklappen sidder lavere end normalt (figur 9). Kriteriet for Epsteins anomali er, at tricuspidalklappens plan er placeret >10 mm apikalt i forhold til mitralklappens plan. Trikuspidalklappen kan forskyde sig ned mod højre ventrikels apex, og generelt er der en mere eller mindre udtalt trikuspidalregurgitation.
Medfødt korrigeret transposition af de store arterier (CCTGA)
Transposition af de store arterier (TGA) betyder, at to eller flere af de store blodkar har byttet plads. Ofte har aorta og lungepulsåren byttet plads, hvilket resulterer i, at venstre ventrikel pumper blod ned i lungerne, og højre ventrikel pumper blod ud i det systemiske kredsløb. Blodet i venstre side cirkulerer mellem lungerne og venstre hjerte. Blodet i højre side cirkulerer mellem det systemiske kredsløb og højre hjerte. Det betyder, at blodet, der strømmer gennem det systemiske kredsløb, ikke er iltet, hvilket fører til dødelig hypoxi. Den eneste chance for at overleve er, hvis der er en shunt, som gør det muligt at sende blod mellem kredsløbene. Den åbne ductus arteriosus, ASD og VSD er i disse tilfælde livreddende. I dag opdages disse misdannelser hurtigt, og de kan korrigeres kirurgisk.
Korrektion af transposition indebærer, at de store kar forbindes igen, så de leder blod fra højre hjertekammer. Højre ventrikel vil derefter fungere som venstre ventrikel og omvendt.
Referencer
- Overlevelse hos børn og unge voksne med medfødt hjertesygdom i Sverige. Mandalenakis Z et al. JAMA Intern Med. 2017;177 (2):224-230.
- Tendenser inden for medfødt hjertesygdom – det næste årti. Triedman et al. Circulation. 2016;133:2716-2733
- Plana et al. Pulsoximetri til diagnosticering af kritiske medfødte hjertefejl. Cochrane-samarbejdet.
