Myokardieiskæmi og -infarkt: Cellulære forandringer, EKG og symptomer
Myokardieiskæmi: cellulære forandringer, EKG-tegn og udvikling af infarkt
Ligesom alle andre celler i menneskekroppen bruger hjertemyocytter ATP (adenosintrifosfat) som den primære energikilde. ATP produceres ved at omsætte kulhydrater (glukose), fedtstoffer eller proteiner, alt efter hvad der er tilgængeligt. ATP driver alle cellulære funktioner, såsom sammentrækning og afslapning. Hvis man øger hjertets arbejdsbyrde ved at øge hjertefrekvensen og kontraktiliteten (dvs. sammentrækningskraften), resulterer det i et øget stofskifte. Hjerteceller er i høj grad i stand til at matche udbuddet og efterspørgslen efter ATP; øget hjertearbejdsbyrde resulterer i øget ATP-produktion og vice versa. Det er vigtigt at bemærke, at hjertemyocytter kræver aerob metabolisme (ilt) for at producere tilstrækkelige mængder ATP. Det betyder, at hjertet har brug for en kontinuerlig blodgennemstrømning for at opretholde cellefunktionen.
Myokardieiskæmi opstår, når der ikke er tilstrækkelig ilt til rådighed. Utilstrækkelig iltforsyning resulterer i nedsat ATP-produktion og efterfølgende forstyrrelse af den cellulære metabolisme. I tilfælde af iskæmi beskytter hjertemyocytterne sig selv ved at skifte til anaerob metabolisme. Det er muligt, fordi hjertemyocytterne lagrer glykogen (en lagringsform af glukose), som kan bruges til at producere ATP i fravær af ilt. Desværre giver glykogen kun små mængder ATP, og glykogenforsyningerne er begrænsede. For at reducere iltbehovet holder hjertemusklerne op med at trække sig sammen under anaerobe forhold (dvs. under iskæmi). Disse to foranstaltninger – dvs. at skifte til anaerob metabolisme og stoppe sammentrækningerne – gør myokardiet i stand til at udholde 20 til 30 minutters svær iskæmi. Hvis myokardieperfusionen (blodgennemstrømningen) i den iskæmiske zone ikke er genoprettet inden for denne tidsgrænse, vil cellen dø.
Myokardieiskæmi i klinisk praksis: koronararteriesygdom
I klinisk praksis forekommer myokardieiskæmi i mange situationer. Ved stabil angina pectoris er der aterosklerotiske plaques, som begrænser den koronare blodgennemstrømning og forårsager symptomer under øget myokardiebelastning (motion). Jo mere alvorlig stenosen er, jo mere udtalte er symptomerne. Stabil angina pectoris diagnosticeres ved hjælp af anstrengelsestest (anstrengelses-EKG). Formålet med stresstesten er at øge myokardiets arbejdsbelastning (og dermed iltbehovet) for at fremprovokere iskæmi i myokardiet, der forsynes af aterosklerotiske arterier. Dette medfører også de typiske EKG-forandringer. Ved akut koronarsyndrom er symptomer og EKG-forandringer imidlertid manifeste i hvile på grund af den alvorlige reduktion af koronarflowet forårsaget af akut aterotrombose.
Tabel 1: Myokardie- og EKG-reaktion i forskellige situationer med iskæmi eller øget arbejdsbelastning
| STATUS AF KORONARARTERIE | SETTING | EFFEKT | EKG REAKTION |
| Normal koronararterie (ingen aterosklerose) | I hvile | Iltforsyningen er tilstrækkelig, og der kan ikke opstå iskæmi. | Ingen ændringer på hvile-EKG. |
| Øget myokardial arbejdsbelastning (træning) | Iltforsyningen øges parallelt med det øgede iltforbrug under træning. Dermed er udbud og efterspørgsel afbalanceret, og der opstår ikke iskæmi. (Nogle personer udviser en godartet form for iskæmi lokaliseret i subendokardiet under træning; dette manifesterer sig med ST-segment-sænkninger med opadgående ST-segment under træning, men personen er asymptomatisk). | Ingen ændringer på hvile-EKG. Godartet ST-segmentdepression har et opadgående ST-segment under træningsstresstest. | |
| Stabil koronararteriesygdom (aterosklerotisk plak, der forårsager 70 % stenose eller mere) | I hvile | Ingen symptomer. | Ingen ændringer på hvile-EKG. |
| Øget myokardial arbejdsbelastning (træning) | Iltbehovet stiger med arbejdsbelastningen, men stenosen (aterosklerotisk plak) begrænser den nødvendige stigning i blodgennemstrømningen, hvilket resulterer i myokardieiskæmi. Iskæmien viser sig som brystsmerter. Denne type iskæmi (fremkaldt af øget arbejdsbelastning) er lokaliseret i det subendokardiale muskellag. Den er reversibel og forsvinder, når træningen stopper. Kun i sjældne tilfælde (hvis iskæmien er alvorlig og langvarig) resulterer det i troponinlækage (dvs. celledød). | Træningsstresstest bruges til at fremprovokere den samme iskæmiske proces, og det kan afsløre ST-segment-sænkninger, nedsat T-bølgeamplitude og, i sjældne tilfælde, ST-segment-hævninger. | |
| Stabil, men alvorlig koronararteriesygdom (aterosklerotisk plak, der forårsager 90 % stenose eller mere) | I hvile | Ilttilførslen øges parallelt med det øgede iltforbrug under træning. Dermed er udbud og efterspørgsel afbalanceret, og der opstår ikke iskæmi. (Nogle personer udviser en godartet form for iskæmi lokaliseret i subendokardiet under træning; dette manifesterer sig med ST-segment-sænkninger med opadgående ST-segment under træning, men personen er asymptomatisk). | Hvile-EKG kan vise ST-afvigelse og/eller T-bølgeforandringer. |
| Plaque-ruptur/erosion med efterfølgende akut koronarsyndrom | På et hvilket som helst tidspunkt | Transmural iskæmi forårsager ST-segmentforhøjelse. Subendokardiel iskæmi forårsager ST-segmentdepressioner. Symptomerne er udtalte (især ved transmural iskæmi) og lindres ikke af hvile eller indgivelse af nitroglycerin. | Hvile-EKG viser ST-afvigelse, T-bølgeændringer og lejlighedsvis QRS-ændringer |
| Enhver status af koronararterie | Vasospasme i koronararterier | Svær aterosklerose kan forårsage iskæmi allerede i hvile. Dette er en alvorlig tilstand, der ligger mellem stabil aterosklerose og akut koronarsyndrom. | Hvile-EKG viser normale ST-segmentforhøjelser, hvilket indikerer, at iskæmien er transmural |
Tiden er en muskel: 30 minutter fra myokardieiskæmi til infarkt
Varigheden af iskæmien er afgørende, når der er sket en okklusion. Myokardiet, der forsynes af den okkluderede arterie, bliver straks iskæmisk og ophører med at trække sig sammen. Som nævnt ovenfor vender cellerne tilbage til anaerob metabolisme for at opretholde levedygtigheden. Det gør det muligt for cellerne at udholde 20-30 minutters iskæmi. Hvis det koronare flow genoprettes inden for denne periode, vil alt iskæmisk myokardium komme sig (efter en kort periode med kontraktil dysfunktion [kaldet bedøvet myokardium]). Hvis det koronare flow ikke genoprettes, vil infarktet begynde, og nekrosen vil sprede sig som en bølgefront i vand, startende i det mest iskæmiske område, som er subendokardiet. Derfra vil infarktet sprede sig mod epikardiet. Se figur 2.
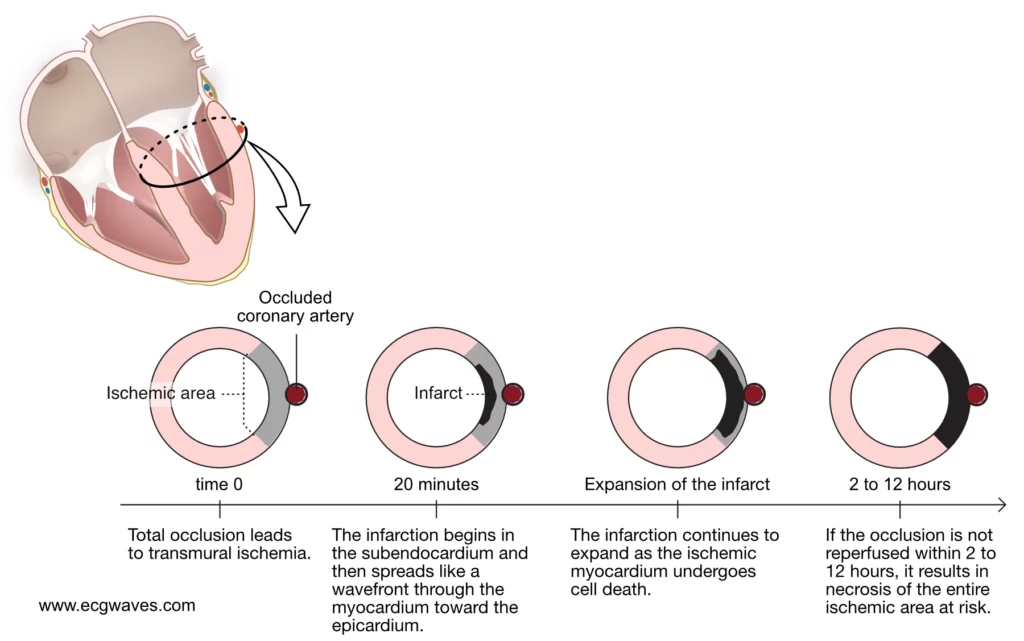
Den tid, det tager for alt iskæmisk myokardium at blive inficeret, er af stor interesse. I litteraturen antydes det traditionelt, at infarktet er afsluttet inden for 4 til 6 timer, men dette trækker i tvivl af nyere undersøgelser, som antyder længere varigheder. Nyere undersøgelser tyder faktisk på, at infarktet kan være afsluttet et sted mellem 2 og 12 timer efter symptomdebut. Dette brede tidsinterval skyldes faktorer, der ændrer det naturlige forløb. En af disse faktorer er tilstedeværelsen af kollateral koronarcirkulation.
Totale okklusioner (som resulterer i akut STEMI) er generelt vedvarende, indtil stort set hele det iskæmiske myokardium er inficeret (medmindre reperfusionsbehandlingen er vellykket). En tredjedel af alle totale okklusioner rekanaliseres spontant inden for 12-24 timer (kranspulsårerne har et trombolytisk system, der håndterer tromben, om end det er for sent). Det skal dog bemærkes, at selv om langt størstedelen af det berørte myokardium vil være nekrotisk, når arterien rekanaliseres, kan genoprettelse af blodgennemstrømningen forbedre den kontraktile funktion og prognosen. Det skyldes, at der kan være myokardium i dvale i eller i nærheden af det berørte område. Dvale-myokardiet er alvorligt iskæmisk, men levedygtigt og kan komme sig helt, hvis blodgennemstrømningen genoprettes. Desuden forbedrer genoprettelse af blodgennemstrømningen helingen af infarktområdet (hvilket giver et stærkere ar) og bremser ventrikulær remodellering (som fører til hjertesvigt).
Figur 3 illustrerer, hvordan infarktet spreder sig fra subendokardiet til epikardiet. Grunden til, at infarktet starter i subendokardiet, er simpelthen, at det har de dårligste forudsætninger i tilfælde af iskæmi. Subendokardiet ligger for langt væk fra hjertekammerets hulrum til at kunne få ilt fra hulrummet. Desuden modtager det blod, som allerede har mistet meget af sin ilt, da det har passeret gennem hovedparten af ventrikelvæggen (koronarblodstrømmen er rettet fra epikardiet til endokardiet (Figur 3).