Træningsfysiologi: fra normal reaktion til myokardieiskæmi og brystsmerter
Fysiologiske principper for træningsstresstest, myokardieiskæmi og iskæmiske symptomer
Det er vigtigt at forstå de grundlæggende principper for træningsfysiologi for at kunne udføre og evaluere træningsstresstesten. Træning fremkalder fysiologiske ændringer såsom øget ventilation, koronar vasodilatation, stigning i blodtrykket osv. Formålet med sådanne ændringer er simpelthen at gøre det muligt for det kardiopulmonale system at øge sin levering af ilt til skeletmuskulaturen og myokardiet. Iltforbruget – og dermed iltbehovet – stiger parallelt med træningsintensiteten. De fysiologiske ændringer (tilpasninger) bliver mere udtalte, når træningsintensiteten øges. Det autonome nervesystem er det første system, der reagerer på træning. Det gør det ved at trække den parasympatiske aktivitet tilbage og øge den sympatiske aktivitet. Det har flere effekter, som diskuteres i detaljer nedenfor. Denne artikel handler om træningsfysiologi, og der vil blive lagt vægt på myokardiets iltforbrug og udviklingen af myokardieiskæmi under træning. EKG-forandringer nævnes kort (en dybdegående diskussion om EKG-forandringer findes i næste artikel).
Fysiologiske effekter af træning
De vigtigste fysiologiske effekter af træning er opsummeret nedenfor.
Parasympatiske fibre innerverer både den sinoatriale (SA) knude og den atrioventrikulære (AV) knude. Parasympatisk stimulering reducerer automatikken i sinoatrialknuden, hvilket sænker hjertefrekvensen. Den parasympatiske aktivitet mindsker også impulsoverførslen i AV-knuden. Tilbagetrækning af parasympatisk aktivitet resulterer således i øget hjertefrekvens og øget impulsoverførsel over AV-knuden.
Sympatiske fibre innerverer hele hjertet, især det ventrikulære myokardium. Sympatisk stimulering har en positiv inotrop effekt (dvs. øger den kontraktile kraft i myokardiet), positiv kronotrop effekt (dvs. øger hjertefrekvensen ved at øge automatikken i sinoatrialknuden) og positiv bathmotrop effekt (dvs. øget impulsoverførsel gennem myokardiet). Øget sympatisk aktivitet resulterer således i øget hjertefrekvens og stærkere sammentrækninger.
Fysisk træning øger det venøse tilbageløb til hjertet, hvilket resulterer i øget forspænding af hjertet. Mekanismerne er som følger:
- Sympatisk aktivitet forårsager sammentrækning af venerne, hvilket øger det venøse tilbageløb til hjertet.
- Kontraherende muskler fungerer som en pumpe, der driver blodet tilbage til hjertet.
- Åndedrætsdybden (volumen) øges, og det reducerer det intrathorakale tryk ved at øge det intrathorakale volumen. Det reducerede intrathorakale tryk vil passivt suge blod tilbage til hjertet.
Stigningen i preload vil føre til øget ventrikulært tryk og volumen, hvilket igen vil øge slagvolumen. Dette forklares med Frank-Starling-mekanismen, som indebærer, at det ventrikulære myokardium reagerer på øget ventrikulært tryk/volumen ved at øge sin kontraktilitet. Frank-Starling-mekanismen forstærkes af de positive inotrope effekter af den sympatiske stimulering. Øget slagvolumen og øget hjertefrekvens fører til øget minutvolumen.
Detsystoliskeblodtryk stiger, når hjertets minutvolumen øges. Det diastoliske blodtryk påvirkes ikke af ændringer i hjertets minutvolumen. Derfor påvirkes det diastoliske blodtryk ikke af træning (af og til kan det endda falde med op til 10 mmHg). Det gennemsnitlige arterielle tryk (MAP) stiger på grund af, at det systoliske blodtryk stiger under træning.
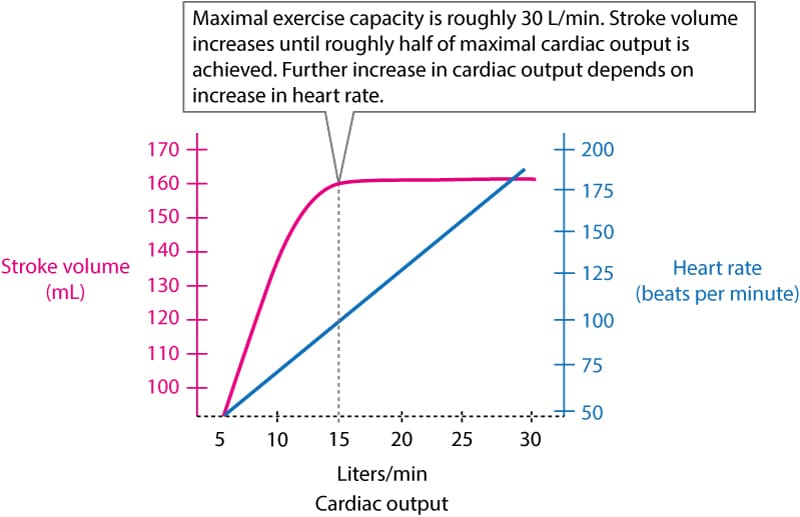
Stigningen i hjertets minutvolumen under moderat træning er et resultat af øget slagvolumen og øget hjertefrekvens. Men når ca. halvdelen af det maksimale minutvolumen er opnået, kan slagvolumen ikke øges yderligere, hvilket betyder, at en yderligere stigning i minutvolumen afhænger af en stigning i hjertefrekvensen. Som illustreret i figur 1 kan hjertets minutvolumen øges 6 gange under maksimal træningsintensitet.
Tilbagetrækning af parasympatisk aktivitet og øget parasympatisk aktivitet forårsager vasokonstriktion i nyrearterierne, abdominalarterierne og huden. Derved omdirigeres blodmængden til muskler, hjerte og hjerne, hvor arterierne i stedet udvides for at give mulighed for øget blodgennemstrømning. Vasodilatation i muskler, hjerte og hjerne er forårsaget af katekolaminer, nitrogenoxid (NO) og ophobning af metaboliske affaldsprodukter. Vasokonstriktion i nyrerne, huden og maven er nogenlunde lig med vasodilatation i hjernen, hjertet og musklerne. I sidste ende påvirkes den perifere vaskulære modstand næsten ikke af træning.
Hjertefrekvens under stresstest
Pulsen skal stige, når træningen starter. Hjertefrekvensen bør derefter stige næsten lineært med arbejdsbelastningen. Veltrænede personer såvel som personer, der bruger betablokkere, udviser en langsommere stigning i hjertefrekvensen. Den maksimale hjertefrekvens er lavere hos ældre på grund af nedsat følsomhed over for katekolaminer. Hjertefrekvensen falder hurtigt i løbet af det første minut af restitutionen (på grund af den vagale aktivitet), og derefter falder hjertefrekvensen langsomt, indtil den er normaliseret (vender tilbage til baseline).
Blodtryksrespons under træningsstresstest
Det systoliske blodtryk bør stige støt under træning. Stort set alle patienter har et systolisk blodtryk på over 150 mmHg. Det diastoliske blodtryk er enten uændret eller kan falde en smule (op til 10 mmHg). Mænd og ældre udviser en mere udtalt stigning i det systoliske blodtryk. Når træningen stopper, falder blodtrykket støt, indtil det er normaliseret, hvilket normalt tager 5 minutter. Bemærk, at det systoliske blodtryk faktisk kan falde til under baseline-niveauet efter træning, og det kan tage op til 6 timer, før det vender tilbage til baseline-værdierne.
Myokardiemetabolisme og iskæmi (iskæmi)
At forstå principperne for myokardiets stofskifte er afgørende for at forstå, hvordan forskellige situationer kan fremkalde myokardieiskæmi og -infarkt. Myokardieiskæmi opstår, når myokardiets iltbehov overstiger iltforsyningen. Med andre ord er iskæmi resultatet af en ubalance mellem iltbehov og iltforsyning. Denne ubalance kan skyldes akut arterieokklusion (dvs. akut koronarsyndrom), kronisk, men stabil koronararteriestenose (dvs. aterosklerose) eller andre ikke-koronare årsager som f.eks. anæmi. De vigtigste determinanter for myokardiets iltforbrug er følgende:
- Blodtryk
- Hjertefrekvens
- Kontraktionskraft (kontraktilitet)
- Spænding i ventrikelvæggen
Iltbehovet er positivt korreleret med hver af disse. Med andre ord, hvis blodtrykket, hjertefrekvensen, kontraktiliteten eller vægspændingen stiger, vil myokardiets iltbehov også stige. Udtrykket ventrikulær væg spænding henviser simpelthen til arbejdsbelastningen på ventrikelvæggen; den bestemmes af trykket i ventriklen, myokardiets tykkelse og ventriklens diameter.
Det er indlysende, at måling af kontraktilitet og vægspænding er for besværligt til rutinemæssig klinisk praksis. Blodtryk og hjertefrekvens er meget lettere at vurdere, og produktet af disse to parametre (hjertefrekvens × blodtryk) giver faktisk et rimeligt estimat af myokardiets iltbehov. Produktet omtales ofte som rate-pressure-produktet (eller dobbeltproduktet eller det kardiovaskulære produkt):
Hastighedstrykproduktet = Hjertefrekvens (bpm) × systolisk blodtryk (mmHg)
Hastighedstrykproduktet er således et estimat af den belastning, som myokardiet udsættes for. Det er baseret på antallet af sammentrækninger pr. minut (hjertefrekvens) og det tryk, som hjertekammeret pumper mod (systolisk blodtryk). Pulstrykproduktet giver en enkel måde at estimere iltbehovet og dermed hjertets energiforbrug på. Målet med stresstest er at opnå et pulstrykprodukt på mindst 25000, hvilket indikerer, at arbejdsbelastningen har været tilstrækkelig.
| Hæmodynamisk respons (arbejdsbelastning) | Bedøm tryk produkt |
|---|---|
| Højt | >30000 |
| Højt mellemliggende | 25000 – 30000 |
| Mellemliggende | 20000 – 25000 |
| Lavt mellemliggende | 15000 – 20000 |
| Lavt | 10000 – 15000 |
Under normale omstændigheder tilpasser den koronare blodgennemstrømning sig myokardiets iltbehov. Koronarblodgennemstrømningen øges under træning for at imødekomme det øgede iltbehov i myokardiet. Myokardieiskæmi opstår, hvis der er aterosklerotiske plaques, som forårsager stenose i arterien. Aterosklerotiske plaques varierer i størrelse; de kan være alt fra ubetydelige til helt udslettede. En lille stenose giver sjældent symptomer i hvile, men den kan give symptomer under træning, fordi iltbehovet stiger under træning (stenosen forhindrer den nødvendige stigning i ilttilførslen). Hastighedstrykproduktet kan bruges til at estimere sværhedsgraden af en stenose; symptomer på iskæmi (angina pectoris) ved lave hastighedstrykprodukter indikerer, at stenosen er alvorlig. Ved en stabil stenose opstår der desuden typisk iskæmiske symptomer ved det samme hastighedstrykprodukt. Hastighedstrykproduktet er dog kun en tilnærmelse til myokardiets arbejdsbelastning, og nogle undersøgelser viser faktisk, at patientens subjektive vurdering af sin præstation er et mindst lige så godt estimat af myokardiets arbejdsbelastning.
Myokardieiskæmi: manglende blodgennemstrømning vs. ubalance mellem udbud og efterspørgsel
Lige siden Eugene Braunwald og hans kolleger fandt ud af, hvad der bestemmer myokardiets iltbehov, har forskere diskuteret, hvad myokardieiskæmi egentlig er for en størrelse. Der er to konkurrerende teorier (den første er allerede blevet præsenteret ovenfor), som kort forklares:
- De fleste forskere er blevet enige om udbuds- og efterspørgselsteorien, som siger, at iskæmi opstår, når efterspørgslen overstiger udbuddet. Med andre ord er iskæmi resultatet af en ubalance mellem udbud og efterspørgsel.
- Den konkurrerende teori siger, at myokardiet aldrig kan opleve ubalance, fordi det tilpasser sit iltforbrug (metabolisme) til iltforsyningen. Med andre ord vil myokardiet reducere sit iltforbrug – og dermed sin kontraktilitet – hvis der ikke er tilstrækkeligt med ilt til rådighed. Derfor følger myokardiecellernes stofskifte iltforsyningen. Metabolismen nedreguleres gradvist, efterhånden som iltforsyningen mindskes; jo mere udtalt iltmanglen er, desto større er reduktionen i metabolismen (og dermed kontraktiliteten). Denne teori understøttes af både forskning og kliniske observationer. For eksempel viser dyreforsøg og kliniske undersøgelser, at når blodgennemstrømningen i hjertets kranspulsårer afbrydes, holder det berørte myokardium straks op med at trække sig sammen og bliver “bedøvet”. Når blodgennemstrømningen vender tilbage, genoptager myokardiet gradvist sine sammentrækninger. Ifølge denne teori kan myokardieiskæmi kun være resultatet af en absolut mangel på ilt.
Interesserede læsere henvises til:
– G Heusch, Myocardial Ischemia. Circ Res, 2016
– E Braunwald, Begrænsning af infarktstørrelse og teorien om den åbne arterie. Circulation, 2016.
Ikke desto mindre er det klart, at graden af stenose korrelerer godt med niveauet af iskæmi. En stenose, der forårsager <50% luminal obstruktion, forårsager måske slet ingen symptomer. En stenose, der forårsager 50-70% luminalobstruktion, forårsager typiske symptomer (angina pectoris) under træning. En stenose, der forårsager 90% luminalobstruktion, forårsager generelt symptomer i hvile. Bemærk, at disse principper modificeres af flere faktorer, hvoraf de vigtigste er:
- Kollateral cirkulation: Kollaterale arterier kan være meget effektive. Faktisk kan en komplet okklusion af den venstre anteriore descenderende arterie (LAD) ikke forårsage nogen symptomer, hvis der er kollaterale kar, der forsyner LAD.
- Placering af stenosen: En proksimal okklusion/stenose vil påvirke en større del af myokardiet sammenlignet med en mere distal okklusion/stenose.
- Koronar autoregulering: Aterosklerotiske kranspulsårer har en tendens til at kompensere for stenosen ved at afslappe den glatte muskulatur omkring den aterosklerotiske plak. Dette resulterer i lokal vasodilatation på stedet for plakken. I de tidlige stadier af aterosklerose er lumen (diameteren) derfor muligvis ikke påvirket af plakken (hvilket er grunden til, at koronarangiografi også kan være falsk negativ). Men efterhånden som den aterosklerotiske proces fortsætter, og plakken vokser, vil den gradvist forårsage en indsnævring af lumen på trods af eventuelle autoregulatoriske mekanismer.
- Stenosens længde: En lang stenose vil have en større indvirkning end en kort stenose.
Den iskæmiske kaskade: fra iskæmi til EKG-forandringer og brystsmerter
Patienter med akut koronarsyndrom, som overvåges med kontinuerlig ST-segmentovervågning, rapporterer kun om symptomer i ca. 40 % af de iskæmiske episoder, der opdages med kontinuerlig ST-segmentovervågning. Det betyder, at 60 % af de iskæmiske episoder er asymptomatiske, hvilket igen betyder, at iskæmisk hjertesygdom ikke kan udelukkes på grund af manglende symptomer. På den anden side vil patienter med symptomatisk iskæmisk hjertesygdom (dvs. angina pectoris) næsten altid vise iskæmiske EKG-forandringer under episoder med brystsmerter. For at opsummere:
- 60 % af alle iskæmiske episoder er asymptomatiske.
- Patienter med brystsmerter på grund af myokardieiskæmi vil stort set altid vise iskæmiske EKG-forandringer.
Den iskæmiske kaskade – som er den sekvens af begivenheder, der finder sted under en iskæmisk episode – forklarer disse forhold. Figur 2 (nedenfor) illustrerer den iskæmiske kaskade. Studér denne figur omhyggeligt, da den tydeliggør, hvorfor fraværet af iskæmiske EKG-forandringer under brystsmerter stort set udelukker myokardieiskæmi som årsag.
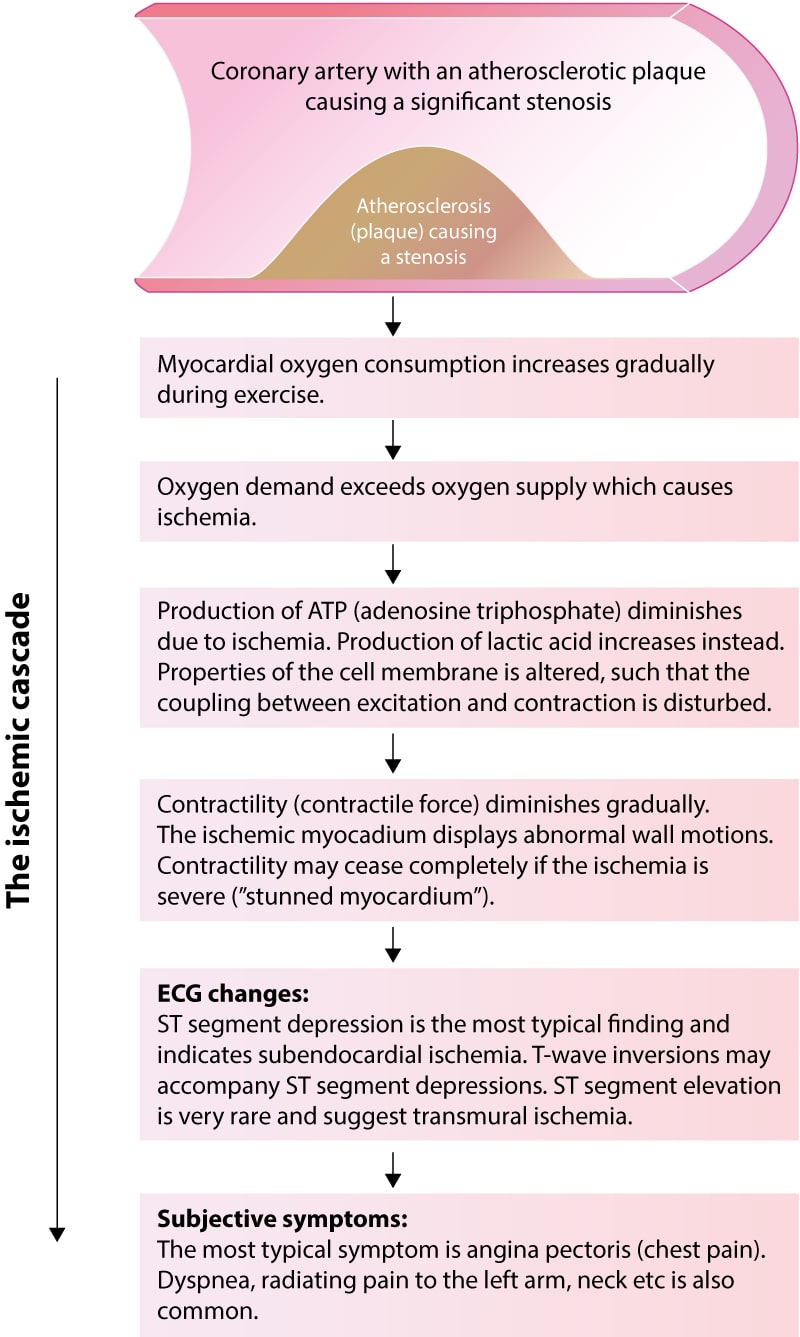
Den iskæmiske kaskade er den sekvens af begivenheder, der finder sted mellem begyndelsen af cellulær iskæmi og kliniske symptomer. Under træning hos patienter med betydelig koronararteriestenose modtager myokardiet mindre ilt, end der er brug for til at opfylde de metaboliske krav. Iltmanglen resulterer i nedsat produktion af ATP (adenosintrifosfat) og øget produktion af mælkesyre. Nedsat produktion af ATP fører til nedregulering af cellulær metabolisme og kontraktilitet. Cellen kan faktisk holde helt op med at trække sig sammen, hvis iskæmien er alvorlig. Udtrykket bedøvet myokardium refererer til myokardium, der står stille på grund af svær iskæmi. Nedregulering af metabolisme og kontraktilitet er nødvendig for, at cellen kan overleve iskæmi (konsekvensen af iskæmi ville være mere alvorlig, hvis de cellulære processer var fortsat uændret under iskæmi). Den nedsatte tilgængelighed af ATP påvirker cellemembranproteinerne (især ionkanaler). Dette resulterer i sidste ende i ændret cellemembranfunktion og ændringer i de elektriske potentialer på tværs af cellemembranen, hvilket igen forårsager ST-segment-sænkninger. Kliniske symptomer (især brystsmerter) opstår, hvis iskæmien får lov til at fortsætte. Denne sekvens af begivenheder er skitseret i figur 2 ovenfor. Bemærk følgende:
- Der er en grænse for, hvor længe cellen kan overleve iskæmi, selv om den nedregulerer stofskiftet. Generelt overlever myokardiet svær iskæmi i 20 minutter, før de iskæmiske celler dør.
- Iskæmien forårsager kun EKG-forandringer, hvis den påvirker nok myokardium. EKG-forandringer opstår før kliniske symptomer. Med andre ord er kliniske symptomer (f.eks. brystsmerter) de sidste begivenheder under en iskæmisk episode. Det betyder, at myokardieiskæmi kan være til stede, selv om der ikke er kliniske symptomer. EKG’et registrerer flere iskæmiske episoder, end patienten oplever.