Stabil koronararteriesygdom (angina pectoris): Diagnose, evaluering og behandling
Evaluering og behandling af stabil koronararteriesygdom
Kronisk koronart syndrom (CCS)
Stabil koronararteriesygdom (CAD), ofte omtalt som stabil angina pectoris, er traditionelt blevet defineret og behandlet som en særskilt klinisk enhed. Kendetegnende for stabil koronararteriesygdom er anstrengelsesrelateret angina pectoris (brystsmerter); symptomer på iskæmi opstår under omstændigheder med øget myokardiebelastning, typisk ved anstrengelse. Nylige retningslinjer udstedt af European Society for Cardiology (ESC) foreslår en ny klassifikation (Knuuti et al, 2019/2020), hvor stabil koronararteriesygdom er en del af det bredere syndrom af kroniske koronarsyndromer (CCS). Dette syndrom omfatter seks kliniske manifestationer af koronararteriesygdom (omtalt nedenfor). Desuden er prognosticering, valg af diagnostiske tests og behandlingsstrategier blevet opdateret. For eksempel anbefales stresstest ikke længere i den indledende evaluering af patienter med mistanke om koronararteriesygdom (dvs. CCS).
De nye retningslinjer er baseret på data fra undersøgelser, der hovedsageligt er udført i Nordamerika og Europa. Desuden omfatter retningslinjeudvalget repræsentanter fra Nordamerika, hvilket gør det meget sandsynligt, at de kommende retningslinjer fra American Heart Association (AHA) og American College of Cardiology (ACC) vil være på linje med de europæiske retningslinjer. Derfor vil dette kapitel præsentere den nyeste evidens og de nyeste anbefalinger for evaluering og behandling af kronisk koronarsyndrom (CCS).
Iskæmisk hjertesygdom, koronar hjertesygdom (CAD) og koronararteriesygdom (CHD) er synonymer. Disse udtryk henviser til symptomatisk koronar aterosklerose.
Traditionel klassificering af koronararteriesygdom
Traditionelt er koronararteriesygdom blevet klassificeret i følgende tre syndromer:
- Stabil angina pectoris: Symptomerne opstår primært under træning eller andre situationer med øget myokardiebelastning. Symptomerne forværres ved at øge anstrengelsesniveauet (dvs. øge myokardiebelastningen) og vice versa. Stabil angina pectoris er en kronisk og for det meste progressiv sygdom.
- NSTE-ACS (Akut koronart syndrom uden ST-elevation): NSTE-ACS er en akut tilstand, der opstår, når en aterosklerotisk plak brister, hvilket forårsager aterotrombose, der resulterer i delvis (ufuldstændig) okklusion af kranspulsåren. NSTE-ACS resulterer i en af følgende diagnoser:
- Myokardieinfarkt uden ST-elevation (NSTEMI, non-STEMI), hvis troponinniveauet er over den øvre tærskel.
- Ustabil angina pectoris (UA), hvis troponinniveauerne er under tærsklen (dvs. normale).
- STE-ACS (akut koronarsyndrom med ST-elevation): STE-ACS opstår, når plakruptur og den efterfølgende aterotrombose forårsager en fuldstændig okklusion af kranspulsåren. Iskæmi vil strække sig fra endokardiet til epikardiet i det berørte myokardieområde, hvilket resulterer i ST-hævninger på EKG’et. Stort set alle patienter med STE-ACS udviser forhøjede troponinniveauer og diagnosticeres dermed som ST-elevationsmyokardieinfarkt (STEMI).
Kroniske koronare syndromer (CCS)
Kranspulsåresygdom er en progressiv, men dynamisk sygdom. Størstedelen af befolkningen i højindkomstlande har en eller anden grad af koronar aterosklerose. Risikofaktorer for aterosklerose (f.eks. rygning, forhøjet blodtryk, diabetes, hyperlipidæmi [især højt LDL-kolesterol] osv.) fremskynder den aterosklerotiske proces og øger antallet og størrelsen af aterosklerotiske plaques.
Typisk er den første manifestation af koronararteriesygdom stabil angina, defineret ved anstrengelsesrelaterede brystsmerter. Patienter med stabil angina pectoris kan udvikle akutte koronare hændelser (akut myokardieinfarkt, ustabil angina) på et hvilket som helst tidspunkt i sygdomsforløbet. Nogle patienter kan opleve et akut koronarsyndrom som den første manifestation af deres kranspulsåresygdom. Desuden kan patienter, der har oplevet akutte koronare hændelser, efter behandling af den akutte hændelse enten være symptomfri eller fortsætte med at opleve angina pectoris og andre symptomer på iskæmi. Kranspulsåresygdom er således en nuanceret og dynamisk tilstand, hvilket de nye retningslinjer afspejler ved at indføre begrebet kronisk koronarsyndrom (CCS). De følgende seks kategorier indgår i CCS-spektret:
- Patienter med mistanke om koronar hjertesygdom med stabil angina (brystsmerter) og/eller dyspnø.
- Patienter med mistanke om koronar hjertesygdom og nyopstået hjertesvigt eller dysfunktion i venstre ventrikel.
- Patienter med stabiliserede symptomer <12 måneder efter akut koronarsyndrom eller revaskularisering.
- Patienter med stabiliserede symptomer >12 måneder efter akut koronarsyndrom eller revaskularisering.
- Patienter med angina pectoris og mistanke om vasospasme eller mikrovaskulær sygdom.
- Asymptomatiske patienter, hos hvem koronar hjertesygdom opdages under screening.
Disse seks kategorier repræsenterer alle de kroniske (ikke-akutte) faser af koronararteriesygdom.
Det naturlige forløb ved koronararteriesygdom
Kranspulsåresygdom er forårsaget af aterosklerotiske læsioner (plaques) i kranspulsårerne. Aterosklerotiske plaques udvikles i løbet af flere årtier. LDL-kolesterol er afgørende for påbegyndelsen og udviklingen af åreforkalkning. Makrofager, T-celler og B-celler er også nøglespillere i dannelsen af aterosklerotiske plaques. LDL-kolesterol og immunceller ophobes i intima og etablerer en kronisk inflammatorisk proces. Arteriens diameter mindskes gradvist, efterhånden som plakken vokser. Risikofaktorer for aterosklerose (f.eks. rygning, forhøjet blodtryk, diabetes, arvelighed osv.) fremskynder den aterosklerotiske proces (Libby et al.).
Formålet med tidlig diagnose og behandling er at bremse, hæmme eller vende den aterosklerotiske proces. Opbremsning og hæmning af den aterosklerotiske proces anses for at være klinisk mulig hos de fleste patienter (dog med vanskeligheder hos patienter med familiær hyperkolesterolæmi). Desuden viser et stigende antal undersøgelser, at det kan være muligt at vende den aterosklerotiske proces ved hjælp af intensiv behandling (højdosis statiner, ezetimibe, PCSK9-hæmmere og intensive livsstilsændringer; Fisher et al).
Medmindre plakken brister, er koronararteriesygdom asymptomatisk, indtil plakken forhindrer tilstrækkelig blodgennemstrømning på tværs af stenosen. Størstedelen af alle stenoser, der obstruerer <50% af diameteren, giver ingen symptomer. Stenoser, der obstruerer 50-90% af lumen, kan forårsage symptomatisk iskæmi. Stenoser, der obstruerer >90% af lumen, forårsager for det meste symptomatisk iskæmi (Knuuti et al, Tonino et al ). Der er således en betydelig redundans i koronarperfusionen.
I de tidlige stadier af koronararteriesygdom opstår der kun iskæmi under træning. Myokardiets iltbehov stiger under træning, men stenosen forhindrer den nødvendige stigning i ilttilførslen (dvs. koronarperfusionen). Efterhånden som åreforkalkningen skrider frem, bliver stenosen større, så der kræves lavere træningsniveauer for at fremkalde angina.
På et hvilket som helst tidspunkt i sygdomsforløbet kan der opstå et akut koronart syndrom. Det skyldes de aterosklerotiske plaquers sårbarhed. Plaques kan briste helt, eller der kan opstå erosion på hætten. Begge scenarier resulterer i, at vaskulært kollagen bliver udsat for von Willebrand-faktor (vWF) i blodet, hvilket udløser trombocytaktivering, aggregering og aterotrombose. Tromben kan forårsage en fuldstændig eller delvis (ufuldstændig) okklusion af arterien. Komplette okklusioner forårsager typisk STEMI, mens delvise okklusioner fører til NSTEMI eller UA.
Plaque-ruptur eller -erosion kan forekomme i små eller store plaques, hvilket betyder, at et akut koronart syndrom kan forekomme både tidligt og sent i sygdomsforløbet. Det forklarer, hvorfor akut koronarsyndrom kan være den første kliniske manifestation af koronar hjertesygdom, også hos unge mennesker (Arbab-Zadeh et al.).
Definition af stabil og ustabil angina
Stabil kranspulsåresygdom (angina pectoris)
Ved klassisk angina pectoris er smerten typisk lokaliseret nær brystbenet. Smerterne kan stråle ud i ryggen, nakken, kæben eller armene. Iskæmi/infarkt i den nedre væg kan forårsage smerter, der primært er lokaliseret i epigastriet.
Smerten beskrives typisk som et tryk, en krampe, en stramhed, en tyngde eller et ubehag i brystet. En brændende fornemmelse er mindre almindelig og kan forveksles med gastroøsofageal refluks. Smerter eller ubehag forårsaget af myokardieiskæmi har ingen sammenhæng med åndedrætsbevægelser, brystkasse- eller kropsbevægelser. At instruere patienter i at tage dybe indåndinger, holde vejret og udføre brystbevægelser (rotation, ekstension, fleksion) kan belyse dette. Koldsved, træthed og angst er almindeligt under myokardieiskæmi og -infarkt.
Dyspnø er også almindeligt under angina, især blandt ældre, kvinder og personer med diabetes. Da dyspnø kan være den eneste manifestation af myokardieiskæmi, betragtes den som en anginal ækvivalent.
Varigheden af brystsmerter er mindre end 10 minutter hos patienter med stabil angina pectoris, og de fleste episoder varer et eller et par minutter (forudsat at den aktivitet, der fremkalder smerten, er stoppet). Brystsmerter, der varer nogle få sekunder, er en almindelig klage, både i primærsektoren og på skadestuen, og er sjældent forårsaget af iskæmi. Iskæmiske brystsmerter, der varer >10 minutter, skyldes sandsynligvis et akut koronart syndrom. Patienter med stabil koronararteriesygdom bør derfor instrueres i at søge lægehjælp, hvis brystsmerterne varer 10 minutter eller længere, især hvis indgift af nitrater ikke lindrer smerterne.
Nitrater fremkalder arteriel og venøs vasodilatation, som reducerer venstre ventrikels for- og efterbelastning og dermed reducerer myokardiets arbejdsbelastning. Nitrater lindrer angina inden for et eller to minutter. Det kan være nødvendigt med flere doser (se nedenfor), afhængigt af sværhedsgraden af iskæmien. Da nitrater kan have en placebo-effekt, er det ikke muligt at udelukke myokardieiskæmi baseret på responsen på nitrater. Sandsynligheden for iskæmi som den underliggende årsag øges dog, hvis nitrater lindrer symptomerne.
Angina pectoris forværres af fysisk anstrengelse, koldt vejr, tunge måltider og i morgentimerne. Niveauet af fysisk anstrengelse, der forårsager angina, kaldes anginaltærsklen. Denne tærskel kan variere fra dag til dag. Opvarmningsangina er et usædvanligt fænomen, hvor træningsinduceret iskæmi reduceres eller forsvinder ved anden anstrengelse efter første anstrengelse efter en kort pause (Williams et al.).Walk-through angina, et sjældent fænomen, defineres som fremkomsten af angina i de første faser af træningen med forsvinden af brystsmerter ved højere arbejdsbelastninger på trods af et større hastighedstrykprodukt (Gavazzi et al).
Ved stabil angina er symptomerne stabile over tid (ingen forværring inden for den seneste måned), og der er ingen symptomer i hvile.
EKG’et ved stabil koronararteriesygdom
EKG’et viser ingen tegn på akut iskæmi i hvile, medmindre der er vedvarende myokardieiskæmi, som kan være symptomatisk eller asymptomatisk.
Anbefalet kapitel: EKG ved myokardieiskæmi.
Troponinniveauer ved stabil koronararteriesygdom
Troponinniveauet er normalt hos de fleste patienter med stabil angina pectoris. Det skal dog bemærkes, at op til 30 % af patienterne med stabil koronararteriesygdom kan udvise forhøjede troponinniveauer (Everett et al.), hvilket er forbundet med en øget risiko for kardiovaskulær død. Disse patienter udviser konstant forhøjede troponinniveauer sammenlignet med de dynamiske ændringer, der observeres under akut myokardieinfarkt.
Stabil angina pectoris klassificeres i henhold til kriterierne i tabel 1. Denne klassifikation er udelukkende baseret på symptomer og bruges til at vurdere sandsynligheden for, at symptomerne skyldes myokardieiskæmi (angina).
Tabel 1. Klassificering af angina pectoris.
| Klassifikation | Definition |
|---|---|
| Typisk angina pectoris | Typisk angina opfylder alle tre af følgende kriterier: 1) Trykgener anteriort på brystkassen, i nakken, kæben, skuldrene eller armen. 2) Angina ved fysisk anstrengelse 3) Smerten lindres ved hvile eller ved hjælp af nitropræparater |
| Atypisk angina pectoris | Atypisk angina opfylder to af de tre ovenstående kriterier. |
| Ikke-anginale brystsmerter eller ubehag | Ikke-anginøse brystsmerter opfylder et eller ingen af kriterierne. |
Definition af ustabil angina pectoris (UA)
Ustabil angina pectoris er et akut koronart syndrom og er til stede, hvis noget af det følgende forekommer:
- Angina i hvile.
- Nyopstået angina (inden for de sidste 2 måneder) i CSS-klasse II til III (Tabel 2).
- Crescendo angina (angina, der er blevet markant værre inden for de seneste dage eller uger).
Tabel 2. Canadian Cardiovascular Society’s klassifikation af angina pectoris
| Klasse | Sværhedsgrad |
|---|---|
| Klasse I | Angina kun under anstrengende eller langvarig fysisk aktivitet. |
| Klasse II | Let begrænsning med angina kun under kraftig fysisk aktivitet. |
| Klasse III | Symptomer i forbindelse med hverdagsaktiviteter, dvs. moderat begrænsning. |
| Klasse IV | Manglende evne til at udføre nogen aktivitet uden angina eller angina i hvile, dvs. alvorlig begrænsning. |
Evaluering af mistanke om kronisk koronararteriesygdom
Sensitivitet og specificitet for diagnostiske tests
En diagnostisk test defineres i denne sammenhæng som en undersøgelse, der kan diagnosticere eller udelukke koronararteriesygdom. Alle diagnostiske tests kan evalueres ved hjælp af følgende parametre:
- Sensitivitet: andelen (%) af positive (dvs. som har kranspulsåresygdom), der er korrekt identificeret.
- Specificitet: Andelen (%) af negative (dvs. som ikke har koronararteriesygdom), som er korrekt identificeret.
- PPV (positiv prædiktiv værdi): Sandsynligheden (%) for, at patienten har sygdommen, hvis testen er positiv.
- NPV (negativ prædiktiv værdi): Sandsynligheden (%) for, at patienten ikke har sygdommen, hvis testen er negativ.
- PTP (præ-test sandsynlighed): Sandsynligheden for, at patienten har sygdommen (koronararteriesygdom), baseret på anamnesen og de kliniske fund.
Prætestsandsynlighed er relateret til Bayes’ sætning, som siger, at sandsynligheden for en begivenhed er afhængig af sandsynligheden for en tidligere begivenhed. I dette scenarie afhænger sandsynligheden for, at en patient har koronararteriesygdom, af alder, kolesterolniveauer, rygestatus, blodtryk, type af symptomer osv. Den kliniske nytte af Bayes-sætning kan ikke overvurderes. Det er afgørende at vurdere sandsynligheden før testen, før man foretager nogen undersøgelser.
Traditionelt har trænings-EKG været førstevalget til evaluering af patienter med mistanke om koronararteriesygdom. Dette er blevet revideret i de nye retningslinjer (Knuuti et al). Belastnings-EKG er ikke længere den anbefalede første test. Trænings-EKG anbefales i dag kun til at evaluere følgende:
- Vurdering af træningskapacitet.
- Vurdering af risikoen for at udvikle arytmier under træning.
- Evaluering af effekten af behandlinger (f.eks. medicin mod angina pectoris) og indgreb (f.eks. CABG, PCI).
- Vurdering af anginaltærskel.
- Evaluering af blodtryksreaktion.
Tabel 3 viser sensitiviteten og specificiteten af forskellige tilgængelige diagnostiske test.
Tabel 3: Testfølsomhed og -specificitet for koronararteriesygdom
| Modalitet | Sensitivitet (%) | Specificitet (%) |
|---|---|---|
| Træningsstresstest (trænings-EKG) | 40-50% | 85 -90% |
| Stress-ekkokardiografi | 80-85% | 80-88% |
| Stress-SPECT | 73-92% | 63-87% |
| Stress-ekkokardiografi med dobutamin | 79-83% | 82-86% |
| Stress-MRI med dobutamin | 72-79% | 81-91% |
| Stress-ekkokardiografi med vasodilatator | 90-91% | 75-84% |
| Stress-SPECT med vasodilatator | 67-94% | 61-85% |
| CTA koronararterie | 95-99% | 64-83% |
| Stress-PET med vasodilatator | 91-97% | 74-91% |
Evaluering af mistænkt koronararteriesygdom med angina pectoris og/eller dyspnø
Figur 1 opsummerer undersøgelsen og håndteringen af patienter med mistanke om koronararteriesygdom. Proceduren består af seks trin, som diskuteres nedenfor.
Trin 1. Anamnese og klinisk undersøgelse
Symptomer og sygehistorie er grundlæggende i udredningen af mistanke om koronar hjertesygdom. Brystsmerterne klassificeres i en af følgende tre kategorier: typisk angina, atypisk angina eller ikke-anginal brystsmerte (Tabel 1).
Hvis symptomerne tyder på et igangværende akut koronart syndrom (AKS), skal det afgøres, om der er tale om STEMI eller NSTEMI/UA, og der skal iværksættes passende foranstaltninger. Det er afgørende altid at udelukke et igangværende akut koronart syndrom hos patienter, der er under evaluering.
Risikofaktorer for koronararteriesygdom skal undersøges nøje. Disse omfatter hyperlipidæmi (dyslipidæmi, højt LDL-kolesterol), diabetes (type 1-diabetes, type 2-diabetes), rygning, forhøjet blodtryk, arvelighed, lavt indtag af frugt og grøntsager, fysisk inaktivitet, mandligt køn og høj alder. Sandsynligheden for koronararteriesygdom stiger eksponentielt med antallet af risikofaktorer (Yusuf et al, INTERHEART Study).
Trin 2. Vurder prognose, livskvalitet og komorbiditet
Undersøgelsesindsatsen afhænger af patientens præferencer og helbredsstatus. Patienter, der foretrækker at blive undersøgt, og som har en betydelig livskvalitet samt forventet levetid, bør undersøges. Patienter med alvorlig komorbiditet, lav livskvalitet og/eller lav forventet levetid bør ikke undersøges yderligere. Disse patienter kan diagnosticeres på baggrund af resultaterne i trin 1 og efterfølgende tilbydes OMT (optisk medicinsk behandling).
Trin 3. Blodprøver, EKG, ekkokardiografi, MR og røntgen af brystet
EKG
Alle patienter bør undersøges med et 12-afledningers hvile-EKG. Følgende principper gælder med hensyn til EKG-forandringer:
- EKG’et viser ST-afvigelse under igangværende iskæmi:
- ST-depression og ST-elevation indikerer igangværende iskæmi.
- EKG’et viser T-bølge inversion (negative T-bølger ) efter en iskæmisk episode (post-iskæmisk T-bølge inversion ).
- EKG’et viser patologiske Q-bølger eller R-bølgeprogression efter manifestation af myokardieinfarkt.
Hvis en patient oplever brystsmerter, når der optages et 12-afledningers EKG, og EKG’et ikke viser ST-afvigelser, er det meget usandsynligt, at brystsmerterne skyldes iskæmi. Patienter med vedvarende iskæmiske brystsmerter udviser stort set altid ST-afvigelser på EKG’et.
Læs mere om dette: Den iskæmiske kaskade.
Følgende EKG-forandringer korrelerer med, men er ikke specifikke for, koronar hjertesygdom:
- Venstre grenblok (LBBB) er almindeligt hos personer med koronararteriesygdom.
- AV-blok I, AV-blok II og AV-blok III er også almindelige hos personer med koronararteriesygdom.
- Atrieflimren er også forbundet med koronararteriesygdom.
Blodprøver
- Glukose, HbA1c, BMI, talje-hofte-ratio.
- Blodlipider omfatter totalkolesterol, LDL-kolesterol, triglycerider, HDL-kolesterol og non-HDL-kolesterol. Fastende prøver er kun nødvendige i tilfælde af ekstrem hyperkolesterolæmi, eller hvis triglyceriderne er meget høje (Ference et al.).
- Ved mistanke om hyperthyreoidisme eller hypothyreoidisme: TSH, T4, T3.
- Natrium (Na ), kalium (K ), kreatinin, beregning af estimeret GFR (eGFR).
- Ved mistanke om akut koronarsyndrom: troponin T eller troponin I.
- Ved mistanke om hjertesvigt: NT-proBNP eller BNP.
Ekkokardiografi
Ekkokardiografi bør udføres rutinemæssigt hos patienter med koronararteriesygdom. Måling af ejektionsfraktion, systolisk funktion, dimensioner, valvulær funktion, diastolisk funktion osv. kan påvirke behandlinger og undersøgelser.
Magnetisk resonanstomografi af hjertet (MRI af hjertet)
Magnetisk resonanstomografi giver detaljerede og omfattende vurderinger af myokardiets anatomi, funktion og ardannelse samt hjerteklapfunktion. Ardannelse i myokardiet (infarkt) visualiseres ved hjælp af gadoliniumkontrast.
Røntgen af brystkassen
Røntgen af brystkassen er kun indikeret, hvis der er mistanke om kongestiv hjertesvigt.
Trin 4. Beregn PTP og klinisk sandsynlighed for koronararteriesygdom
Pre-test probability (PTP) er sandsynligheden for, at patienten har koronararteriesygdom, baseret på anamnese og kliniske data. Sandsynligheden for koronararteriesygdom er en funktion af sygdomsudbredelse og patientkarakteristika.
Hvis patienten repræsenterer en befolkning med en høj forekomst af koronar hjertesygdom og udviser alle symptomer på sygdommen, så er PTP meget høj. I det scenarie falder nytten af diagnostiske tests, fordi de næsten helt sikkert kun vil bekræfte en allerede sandsynlig diagnose. Det modsatte er også tilfældet; hvis sygdommen er sjælden, og patienten ikke har nogen symptomer, der er forenelige med sygdommen, er det usandsynligt, at en undersøgelse vil afsløre noget nyttigt. Generelt er diagnostiske tests mest nyttige, når de bruges på patienter med en mellemstor sandsynlighed for sygdom.
- Hvis sandsynligheden for koronar hjertesygdom er lav, og undersøgelsen er negativ, kan koronar hjertesygdom udelukkes.
- Hvis sandsynligheden for koronar hjertesygdom er høj, og undersøgelsen er positiv, kan koronar hjertesygdom bekræftes.
Pre-test-sandsynligheden for koronar hjertesygdom estimeres ud fra køn, alder og symptomer (figur 2).
Hvis PTP er <5%, er koronararteriesygdom usandsynlig. Det bør betyde, at andre diagnoser er mere sandsynlige, og at yderligere undersøgelser for koronararteriesygdom kun bør foretages under særlige omstændigheder. Nytten af ikke-invasive tests er størst, hvis PTP er >15%.
Hvis PTP er 5 til 15 %, bør følgende parametre tages i betragtning for at vurdere den kliniske sandsynlighed for koronar hjertesygdom:
- Risikofaktorer
- Medicinsk historie og status
- EKG-fond
- Ekkokardiografisk fond.
Den kliniske sandsynlighed for koronararteriesygdom stiger med antallet af faktorer, der er i overensstemmelse med koronararteriesygdom. Den kliniske sandsynlighed for koronar hjertesygdom er således summen af PTP og ovenstående parametre (risikofaktorer, anamnese, status, hvile-EKG, ekkokardiografi).
Koronar kalkscore kan tages i betragtning ved vurdering af klinisk sandsynlighed. Bemærk dog, at nogle aterosklerotiske plaques har en lav calciumkoncentration på trods af højgradig stenose, hvorfor calciumscore ikke kan bruges til at udelukke koronar hjertesygdom.
Trin 5. Valg af passende diagnostiske tests
Der er tre strategier til diagnosticering af koronararteriesygdom ved hjælp af billeddannelse og funktionelle tests.
- Funktionelle ikke-invasive undersøgelser
- Trænings-EKG → vurdering af iskæmiske EKG-forandringer.
- Stress-ekkokardiografi → vurdering af abnormiteter i vægbevægelsen.
- Stress-MR → vurdering af abnormiteter i vægbevægelser.
- Kontrast (gadolinium) MR → vurdering af perfusionsabnormiteter.
- SPECT → vurdering af perfusionsabnormiteter.
- PET → vurdering af perfusionsabnormiteter.
- Anatomiske ikke-invasive undersøgelser
- CT-angiografi af kranspulsårerne
- Invasiv koronar angiografi (ICA)
- Der er mulighed for at vurdere stenosens hæmodynamiske effekter (med FFR [fraktioneret flowreserve]).
Stress kan fremkaldes ved træning eller ved vasodilatation af kranspulsårerne.
Anatomiske vs. funktionelle tests
Anatomiske ikke-invasive undersøgelser visualiserer koronararteriens lumen og væg. Det giver mulighed for direkte visualisering af aterosklerotiske plaques og kvantificering af en eventuel stenose. Stenosen kvantificeres ved at måle den procentdel af lumen, der er blokeret. CT-angiografi af kranspulsårerne har en meget høj følsomhed over for aterosklerotiske plaques. Denne metode opdager både store og små stenoser, men kan ikke vurdere, om de er hæmodynamisk signifikante. Generelt giver obstruktion <50% af diameteren ingen symptomer (men patienten har stadig aterosklerose og er derfor i risiko for akutte koronare hændelser). Obstruktion i området 50-90% af diameteren kan være hæmodynamisk signifikant (dvs. forårsage angina pectoris og iskæmi). Plaques, der obstruerer >90%, vil med stor sandsynlighed være klinisk signifikante. Ikke desto mindre er en funktionel test nødvendig for at bestemme den hæmodynamiske betydning af enhver plak.
Funktionelle tests er fremragende til at afsløre klinisk signifikante stenoser. Men funktionelle tests opdager ikke subklinisk aterosklerose. CT-angiografi af kranspulsårerne påviser alle niveauer af aterosklerose.
Anbefalinger til valg af diagnostiske tests
CT-angiografi af kranspulsårerne er den foretrukne metode, hvis den kliniske sandsynlighed er i det lavere interval. Bemærk, at denne undersøgelse ikke er egnet til patienter med igangværende atrieflimren (eller andre arytmier, der forårsager uregelmæssig rytme) eller høj koronar kalkscore, da billedkvaliteten er hæmmet i disse scenarier.
Ikke-invasiv funktionsundersøgelse foretrækkes, hvis den kliniske sandsynlighed er i den højere ende, eller hvis patienten har kendt koronararteriesygdom. En positiv ikke-invasiv funktionstest indikerer, at der findes en klinisk signifikant stenose.
Invasiv angiografi udføres, hvis ikke-invasive undersøgelser har været inkonklusive, og mistanken fortsat er til stede. Invasiv angiografi kan også overvejes som en indledende test, hvis den kliniske sandsynlighed er meget høj, den kortsigtede risiko for kardiovaskulære hændelser er høj, og/eller hvis der fortsat er udtalte symptomer på trods af optimal medicinsk behandling.
Trin 6. Vurder prognose og risiko for kardiovaskulære hændelser
Alle patienter bør modtage optimal medicinsk behandling (OMT). I løbet af sygdomsforløbet bør risikoen for myokardieinfarkt og kardiovaskulær død revurderes, og indikationen for invasiv angiografi bør løbende revurderes. Formålet med angiografi er at vurdere behovet for revaskularisering (omtalt nedenfor).
Behandling af koronararteriesygdom
Behandlingsmålene for patienter med koronararteriesygdom omfatter følgende:
- Forbedre prognosen (dvs. forlænge overlevelsen).
- Reducere symptomer.
- Forbedre funktionsevnen.
- Forbedre livskvaliteten.
Store kliniske forsøg måler typisk effekten af en intervention på risikoen for nye eller tilbagevendende kardiovaskulære hændelser, udvikling af komplikationer (f.eks. hjertesvigt) og dødelighed. Sådanne resultatmål kaldes hårde endepunkter. Meget få lægemidler har effekt på hårde endepunkter, især dødelighed. De mest effektive lægemidler, som defineret ved det antal, der er nødvendigt for at behandle, hos patienter med stabil koronararteriesygdom, er uden tvivl aspirin (acetylsalicylsyre) og statiner (Collins et al.). Andre almindeligt anvendte lægemidler, f.eks. angiotensin-konverterende enzym (ACE)-hæmmere, angiotensin II-receptorblokkere (ARB), betablokkere, calciumkanalblokkere osv. har ringe eller ingen signifikant effekt på hårde endepunkter. Effekten af ACE-hæmmere, ARB’er og betablokkere ser ud til at være begrænset til patienter med forhøjet blodtryk, dysfunktion i venstre ventrikel og/eller hjertesvigt.
Tværfaglig behandling
Behandling af patienter med koronararteriesygdom (dvs. kronisk koronarsyndrom) kræver et tværfagligt team, der ledes af en læge og en sygeplejerske. De fleste patienter kan behandles i primærsektoren, medmindre symptomerne eller sygdomsudviklingen er ildevarslende. Det tværfaglige team omfatter læger, sygeplejersker, fysioterapeuter, diætister, psykologer, terapeuter og andre. Kliniske forsøg viser, at tværfaglig behandling øger trivslen, tilslutningen til medicinsk behandling, kontrollen med multifaktorielle risikofaktorer og PROM (patientrapporterede resultatmål).
Det skal bemærkes, at selv i sundhedssystemer med stort set fri adgang til medicin bruger patienter med akut myokardieinfarkt typisk 50 % af deres ordinerede doser af statiner og aspirin (Hero et al.). Overholdelse af al medicin skal løbende overvåges og fremmes.
En læge er ansvarlig for at iværksætte medicinsk behandling og vurdere, om kendte eller formodede sameksisterende tilstande kræver yderligere undersøgelser og behandlinger. Alle medicinske behandlinger skal følges op for at vurdere bivirkninger, titrere doser og vurdere, om yderligere behandling er berettiget.
Rygestop
Rygning er næst efter dyslipidæmi den stærkeste risikofaktor for koronararteriesygdom og akut myokardieinfarkt. Rygestop bør fremmes ved hjælp af rådgivning og farmakologisk behandling. Alle former for systematisk rådgivning er effektive og øger sandsynligheden for rygestop. Nikotinerstatning, bupropion og vareniclin er sikre og mere effektive end placebo (Mills et al.).
E-cigaretter kan være mere effektive end nikotinerstatning, selvom de langsigtede virkninger af e-cigaretter er ukendte, og der er rapporter om skadelige virkninger (Hajek et al)
Kost og koronararteriesygdom
Patienter med koronar hjertesygdom bør ifølge European Society for Cardiology og American Heart Association øge indtaget af flerumættet fedt, fibre, bælgfrugter, nødder, grøntsager og frugt. Mættet fedt, rødt kød, sukkerholdige drikkevarer og kulhydratrig mad bør undgås.
Det skal dog bemærkes, at flere store kliniske forsøg har vist, at en kulhydratfattig kost (dvs. en fedtfattig kost) kan have en mere gavnlig effekt på blodlipider, blodtryk og inflammatoriske markører (Shai et al, NEJM). Der er også undersøgelser, der tyder på, at mættet fedt ikke øger risikoen for koronararteriesygdom (Dehghan et al, The Lancet), og den mangeårige opfattelse af, at fiskeolie (omega 3) beskytter mod koronararteriesygdom, mangler evidens (Aung et al, JAMA).
Der er også tegn på, at en middelhavskost kan være gavnlig i forhold til at reducere risikoen for kardiovaskulære hændelser (Estruch et al, NEJM).
På trods af uoverensstemmelserne i kostdataene er det rimeligt at anbefale et øget indtag af frugt, nødder, grøntsager, bælgfrugter og umættede fedtstoffer. Fiber og hvidt kød bør foretrækkes frem for carobhydrater med højt glykæmisk indeks og rødt kød (selvom sidstnævnte også drages i tvivl af data).
Det er vigtigt at skelne mellem kostens lipider og blodets lipider. Sammenhængen mellem kostens lipider (fedt) og blodets lipider (herunder LDL-kolesterol) er generelt svag. Patienter med et meget højt fedtindtag (herunder mættet fedt) kan have et lavt LDL-kolesterol og omvendt (Mente et al, The Lancet).
Alkohol
Indtagelse af 1-2 standarddrikke om dagen er ikke forbundet med en øget risiko for akut myokardieinfarkt. Den laveste samlede dødelighed ses ved nul alkoholindtag (The GBD Study, The Lancet).
Overvægt og fedme
Overvægt (defineret som BMI 25-30 kg/m) og fedme (defineret som BMI >30 kg/m2) forårsager dyslipidæmi (hyperlipidæmi), hypertension, dysglykæmi (hypergylkæmi), diabetes, koronararteriesygdom, perifer arteriesygdom, akut myokardieinfarkt, hjertesvigt, specifikke kræftformer og for tidlig død (Heymsfield, NEJM, 2017). Risikoen for disse komplikationer stiger med BMI.
BMI er dog ringere end talje-hofte-ratio (WHR) med hensyn til at forudsige kardiovaskulære hændelser og diabetes. Det skyldes, at taljeomkredsen korrelerer bedre med central fedme, som er kausalt forbundet med det metaboliske syndrom, diabetes, kardiovaskulære risikofaktorer og hændelser.
Vægttab anbefales til patienter med BMI >25 kg/m2. Anbefalet BMI for patienter med koronararteriesygdom er 20-25 kg/m2. Anbefalinger for taljeomkreds er som følger:
- Kvinder: ≤80 cm
- Mænd, kaukasiske eller afroamerikanske: ≤94 cm
- Mænd, sydasiatiske: ≤90 cm
Sydasiater har højere risiko for diabetes på alle BMI-niveauer (Ramachandran et al, The Lancet).
Den mest effektive metode til vægttab er at reducere kalorieindtaget. Diæter med lavt kalorieindhold resulterer i øjeblikkeligt vægttab, men er vanskelige at opretholde. Faktisk vil enhver diæt, der resulterer i kaloriereduktion, medføre vægttab, herunder modediæter (f.eks. kulhydratfattig diæt, Atkin’s diæt osv.). Der er ikke noget, der entydigt beviser, at en bestemt diæt har metaboliske fordele. En nylig undersøgelse sammenlignede gastrisk bypass og kaloriereduktion og rapporterede, at vægttabsmetoden ikke var af betydning (Johannis, NEJM, 2020).
Gastrisk bypass bør overvejes hos patienter med svær fedme.
Glukagonlignende peptid-1-receptoragonister, også kendt som GLP-1-receptoragonister eller inkretinmimetika, er agonister for GLP-1-receptorer. De er indiceret til behandling af både type 2-diabetes og fedme. GLP-1-receptoragonister resulterer i et gennemsnitligt vægttab på 4 kg (ved at reducere appetitten), samtidig med at de reducerer risikoen for kardiovaskulære hændelser. Aktuelt tilgængelige GLP-1-receptoragonister:
- Exenatide (Byetta, Bydureon), godkendt i 2005/2012.
- Liraglutid (Victoza, Saxenda), godkendt i 2010.
- Lixisenatid (Lyxumia i Europa, Adlyxin i USA).
- Albiglutid (Tanzeum, godkendt i 2014).
- Dulaglutid (Trulicity, godkendt i 2014).
- Semaglutid (Ozempic, Rybelsus).
Diabetes
Kranspulsåresygdom er den hyppigste dødsårsag hos mennesker med diabetes. Åreforkalkning accelererer hos personer med type 1-diabetes og type 2-diabetes (Rawshani et al, The Lancet). Retningslinjerne anbefaler at starte statinbehandling i 40-årsalderen hos alle personer med diabetes (The Heart Protection Study, The Lancet). Med hensyn til glykæmi har de fleste undersøgelser vist, at glykeret hæmoglobin A1c (HbA1c, A1c) er den bedste prædiktor for makrovaskulær sygdom (akut myokardieinfarkt, koronararteriesygdom, slagtilfælde, perifer arteriesygdom), hjertesvigt og mikrovaskulær sygdom (retinopati, neuropati, nefropati). Eksistensen af mikrovaskulær sygdom er en stærk prædiktor for makrovaskulær sygdom.
Multifaktoriel risikofaktorkontrol er nøglen til at reducere risikoen for akut myokardieinfarkt og hjertesvigt hos personer med diabetes (Rawshani et al, NEJM). Detaljer om håndtering af hyperglykæmi er beskrevet i American Diabetes Association’s Standards of Care og European Association for the Study of Diabetes Guidelines:
Betablokkere
Betablokkere binder sig til beta-adrenoceptorer og blokerer effekten af noradrenalin og adrenalin. Betablokkere hæmmer dermed den sympatiske aktivitet. Ikke-selektive betablokkere blokerer både beta-1 (β1) og beta-2 (β2) adrenoceptorer. Selektive betablokkere foretrækkes til patienter med koronararteriesygdom samt hjertesvigt og er relativt selektive for hjertets β1-adrenoceptorer.
Ved at hæmme den sympatiske aktivitet reduceres betablokkere hjertefrekvensen og myokardiets kontraktilitet (dvs. betablokkere har en negativ inotrop effekt). Nedsat hjertefrekvens og kontraktil kraft resulterer i reduceret myokardiebelastning og iltforbrug. Reduktion af hjertefrekvensen fører også til forlængelse af diastolen, hvilket øger tidsperioden for myokardieperfusion (koronarperfusion forekommer under diastolen).
Betablokkere lindrer angina pectoris, sænker blodtrykket, forbedrer træningskapaciteten og reducerer iskæmiske episoder. Alle patienter med koronar hjertesygdom bør behandles med betablokkere, på trods af at flere randomiserede forsøg ikke har kunnet påvise, at betablokkere forbedrer overlevelsen hos patienter med koronararteriesygdom, medmindre de har haft et akut myokardieinfarkt. Alle tilgængelige betablokkere er lige effektive.
Hvilepulsen bør være 55 til 60 bpm ved brug af betablokkere.
Tabel 4: Betablokkere.
| Kategori | Midler |
|---|---|
| Ikke-selektive betablokkere | Propranolol Bucindolol (har α1-blokerende aktivitet) Carteolol Carvedilol (har α1-blokerende aktivitet) Labetalol (har α1-blokerende aktivitet) Nadolol Oxprenolol (har sympatomimetisk aktivitet) Penbutolol (har sympatomimetisk aktivitet) Pindolol (har sympatomimetisk aktivitet) Sotalol (atypisk betablokker) Timolol |
| β1-selektive betablokkere | Acebutolol (har sympatomimetisk aktivitet) Atenolol Betaxolol Bisoprolol Celiprolol (har sympatomimetisk aktivitet) Metoprolol Nebivolol Esmolol Nebivolol (også β1-agonist) |
| β2-selektive betablokkere | Butaxamin |
Behandling med betablokkere titreres langsomt. En startdosis på 25 mg metoprolol en gang dagligt er sikker og kan fordobles hver anden uge, indtil den maksimalt tolererede dosis eller den maksimale dosis (200 mg) er opnået. Betablokkere tolereres godt, og kun få patienter har klinisk signifikante bivirkninger, der kræver seponering af behandlingen. Indikationen for betablokkere er relativt stærk, og seponering sker kun efter nøje overvejelse.
Hvis betablokkere ikke giver tilstrækkelig symptomlindring (eller forårsager uønskede bivirkninger), kan calciumkanalblokkere (diltiazem, verapamil[amlodipin hos patienter med hjertesvigt]) afprøves.
De fleste patienter med kronisk obstruktiv lungesygdom (KOL) tåler betablokkere på trods af den teoretiske risiko for forværring af luftvejsobstruktion. Ikke-selektive betablokkere bør undgås hos patienter med KOL.
Indikationen for behandling med betablokkere er meget stærk hos patienter med hjertesvigt, så seponering bør kun overvejes, hvis det er absolut nødvendigt.
Seponering af betablokkere sker gradvist over en periode på 30 dage.
Bivirkninger af betablokkere: AV-blok, depression, impotens, mareridt, bradykardi, træthed, nedsat arbejdsevne, bronkospasme. Maskering af hypoglykæmi nævnes ofte som en bivirkning i litteraturen, selv om det er meget sjældent i klinisk praksis; diabetes er ikke en kontraindikation for betablokkere.
Calciumkanalblokkere (CCB)
Calciumkanalblokkere reducerer hjertefrekvensen og sænker blodtrykket og reducerer dermed angina og iskæmi. Randomiserede kliniske forsøg har ikke påvist en overlevelsesfordel ved calciumkanalblokkere (Knuuti et al). Den anti-anginale effekt af calciumkanalblokkere er på niveau med betablokkere.
Ikke-dihydropyridiner omfatter verapamil og diltiazem. Disse midler sænker hjertefrekvensen, sænker blodtrykket og forhindrer koronar vasospasme. Verapamil bruges ofte til patienter med koronararteriesygdom.
Tabel 5. Calciumkanalblokkere.
| Verapamil | Diltiazem | Amlodipin, Felodipin, Isradipin, Nicardipin, Nifedipin, Nimodipin, Nitrendipin | |
|---|---|---|---|
| KLASSE | Ikke-dihydropyridiner | Ikke-dihydropyridiner | Dihydropyridiner |
| SELEKTIVITET | Hjertets calciumkanaler | Hjertets calciumkanaler og vaskulære calciumkanaler af L-typen. | Vaskulære L-type calciumkanaler |
| NEGATIV INOTROP EFFEKT | Ja, bør undgås ved hjertesvigt. | Ja. Bør undgås ved hjertesvigt. | Nej. Kan anvendes ved hjertesvigt. |
| NEDSÆTTELSE AF HJERTEFREKVENSEN | Ja | Ja | Nej |
| ANTI-ANGINAL EFFEKT | Ja, udtalt. | Ja, udtalt. | Ja, mindre end verapamil og diltiazem. |
| BLODTRYKSSÆNKENDE EFFEKT | Lille | Lille | Udtalt |
| VASOSPASTISK EFFEKT | Reducerer vasospasme. | Reducerer vasospasme. | Reducerer vasospasme. |
| BIVIRKNINGER | Bradykardi, AV-blok, negativ inotrop effekt. Bør ikke kombineres med betablokkere på grund af risiko for AV-blok. | Hjertebivirkninger mindre udtalte sammenlignet med verapamil. Bradykardi, AV-blok, negativ inotrop effekt. Bør ikke kombineres med betablokkere på grund af risiko for AV-blok. | Flushing, hovedpine, overdreven hypotension, ankelødem, refleks takykardi. Amlodipin kan kombineres med betablokkere. |
Ivabradin
Blokerer If (hjertets sjove kanaler) i sinoatrialknuden, hvilket reducerer hjertefrekvensen hos patienter med sinusrytme og dermed reducerer angina og iskæmi. Ivabradin reducerer ikke risikoen for kardiovaskulære hændelser hos patienter med koronararteriesygdom (Fox et al).
If-kanaler etablerer den pacemakerstrøm, der forårsager spontane depolarisationer i sinoatriale celler. Ivabradin reducerer hjertefrekvensen uden at påvirke blodtrykket eller kontraktiliteten og kan derfor bruges til patienter med hjertesvigt. Den anti-anginale effekt af ivabradin skyldes, at den sænker hjertefrekvensen. Ivabradin er typisk indiceret, hvis hvilepulsen er >70 slag i minuttet.
Mærkenavne: Corlanor, Procoralan.
Ivabradin anbefales til lindring af angina pectoris som andenvalgsbehandling.
Nitrater
Nitrater fremkalder primært venøs vasodilatation ved at øge endotelets produktion af nitrogenoxid (NO). Venøs dilatation resulterer i reduceret venøs tilbagestrømning, reduktion af hjertets forspænding og dermed reduceret myokardiel arbejdsbelastning. Korttidsvirkende nitrater giver øjeblikkelig lindring af angina. Langtidsvirkende nitrater lindrer angina inden for 5 minutter og kan vare i flere timer. Nitrater påvirker ikke dødelighed eller morbiditet. Alle patienter med koronararteriesygdom bør have korttidsvirkende nitrater.
Alvorlig aortastenose og hypertrofisk obstruktiv kardiomyopati er kontraindikationer for nitrater.
Almindeligt anvendte nitrater
- Nitroglycerin
- Sublingual tablet – 0,3 til 0,6 mg, op til 1,5 mg efter behov om dagen
- Transdermalt plaster – 0,2 – 0,8 mg/t, et plaster om dagen (fjernes om natten i 12 timer)
- Kapsel – 5 – 6,5 mg, 3 til 4 gange om dagen
- Spray – 0,4 til 0,8 mg, 1 til 3 gange om dagen; maks. 3 aktiveringer på 15 minutter
- Intravenøs – 10 til 120 μg/min
- Isosorbiddinitrat
- Tablet – 10 til 40 mg 3 gange om dagen
- Sublingual tablet – 2,5 til 10 mg
- Spray – 1,25 mg pr. dosis
- Isosorbid mononitrat
- Tablet – 20 mg til gange dagligt
- Tablet, depotformulering – 30 til 120 dagligt; maksimal daglig dosis 240 mg dagligt
Indgivelse af nitrater under akutte brystsmerter
- Nitrater administreres i siddende stilling.
- Dosis: 0,4 mg nitroglycerinspray eller 0,3-0,6 mg sublingual tablet.
- Dosis gentages hvert 5. minut efter behov, indtil maksimal dosis på 1,2 mg.
- Hvis angina fortsætter efter 15 minutter, bør man mistænke et akut koronart syndrom.
Langtidsvirkende nitrater kan overvejes som angina-profylakse, hvis betablokkere og calciumkanalblokkere ikke er tilstrækkelige. Langtidsvirkende nitrater forværrer refleks-takykardi og må derfor ikke introduceres, før betablokkere er blevet maksimalt titreret. Langtidsvirkende nitrater introduceres gradvist for at undgå bivirkninger.
Bivirkninger vednitrater: hypotension, hovedpine, rødmen, synkope, refleks-takykardi.
Kontraindikationer for nitrater
- Allergi over for nitrater
- Samtidig brug af phosphodiesterase (PDE)-hæmmere som tadalafil og sildenafil.
- Infarkt i højre ventrikel
- Hypertrofisk kardiomyopati
- Alvorlig aortastenose.
Nicorandil
Nicorandil giver anti-anginale effekter og kan bruges som andenvalgsbehandling til refraktær angina.
Ranolazin
Ranolazin har antianginale virkninger og kan anvendes som andenvalgsbehandling af refraktær angina.
Bivirkninger: QT-forlængelse, svimmelhed, kvalme, forstoppelse.
Trimetazidin
Trimetazidin har også antianginale virkninger og kan anvendes som andenvalgsbehandling af refraktær angina.
Hæmning af blodplader (trombocythæmmende medicin)
Blodpladehæmning er det mest effektive middel til at reducere risikoen for ustabil angina, NSTEMI, STEMI, stenttrombose, re-infarkt og kardiovaskulær død hos patienter med koronararteriesygdom. Blodpladehæmning er bedre end antikoagulantia, herunder NOAC’er, når det gælder forebyggelse af aterotrombose. Der er udviklet flere lægemiddelklasser, som alle er rettet mod nøgleelementer i blodpladeaktivering og -aggregering. Figur 3 viser de cellulære og molekylære processer, der resulterer i aterotrombose. Figur 4 viser de cellulære mål, der udnyttes af trombocythæmmende lægemidler.
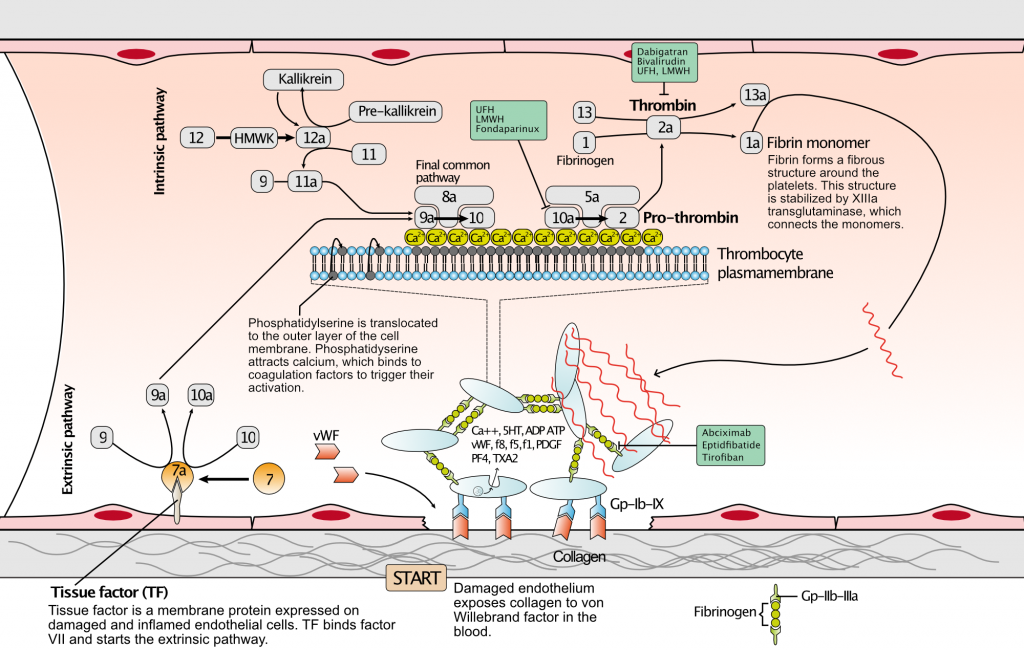
Formålet med trombocythæmmende lægemidler er at hæmme trombocytaktivering og -aggregering (adhæsion) i forbindelse med plakruptur eller -erosion. En bristet eller eroderet plak eksponerer vaskulært kollagen for von Willebrand-faktor i blodet. Binding af von Willebrand-faktor til kollagen gør det muligt for blodplader at hæfte sig til førstnævnte og udløse cellulære processer, der fører til blodpladeaggregering og aktivering af koagulationsfaktorer.
Blodpladeaktivering og -adhæsion afhænger af flere cellulære mekanismer, som trombocythæmmende lægemidler er rettet mod. Alle aktuelt tilgængelige lægemidler inducerer en konstant tilstand af trombocythæmning, hvilket resulterer i en øget risiko for dødelige og ikke-dødelige blødningshændelser. Det er afgørende, at man nøje afvejer blødningsrisikoen med den trombotiske risiko, når man træffer beslutninger om behandling. Dette er særligt vigtigt hos følgende patienter:
- Ældre personer.
- Personer med kronisk nyresygdom (CKD).
- Personer, der gennemgår PCI (primær eller elektiv), da disse patienter kræver kombinationsbehandling med to trombocythæmmende lægemidler i op til 12 måneder efter indgrebet. Kombinationsbehandling med to trombocythæmmende lægemidler kaldes DAPT (dobbelt trombocythæmmende behandling).
- Patienter, der behandles med OAC (orale antikoagulantia), f.eks. atrieflimren, lungeemboli, mekaniske klapper osv.
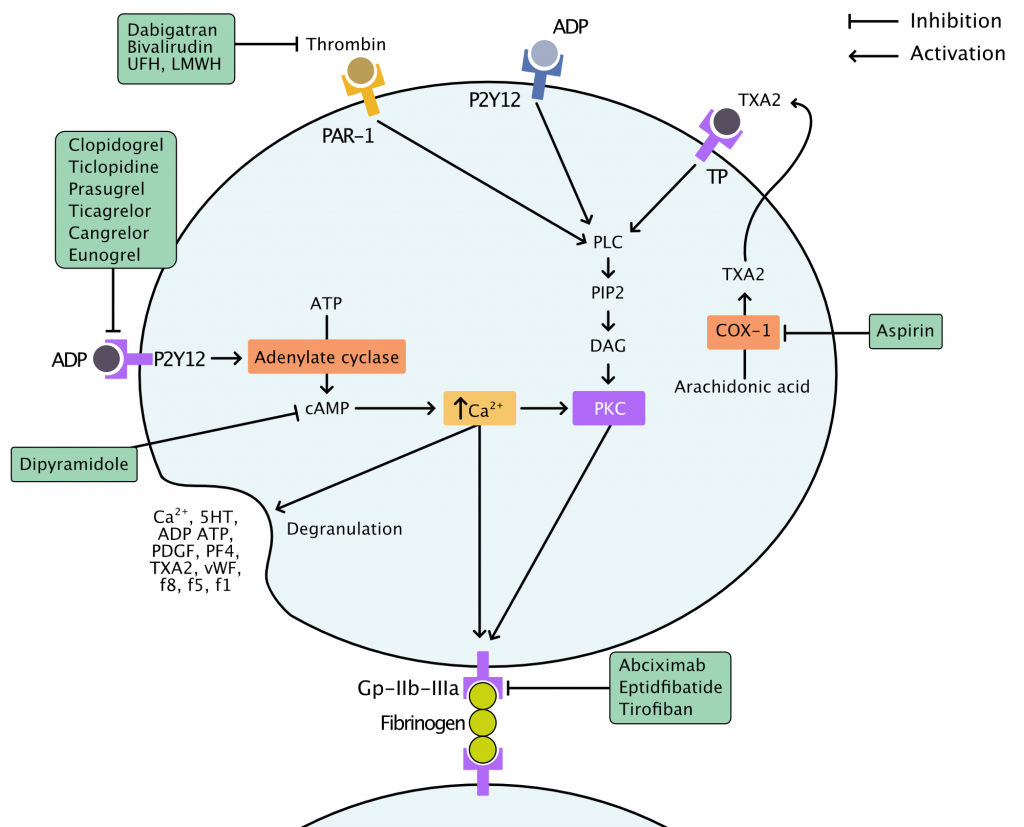
Typer af blodpladehæmmere
- NSAID (ikke-steroide antiinflammatoriske lægemidler): Kun aspirin (acetylsalicylsyre) er godkendt til behandling af koronararteriesygdom.
- Orale P2Y12-hæmmere: clopidogrel, prasugrel, ticagrelor.
- Intravenøse P2Y12-hæmmere: cangrelor.
- Glykoprotein IIb/IIIa (GP IIb/IIIa)-hæmmere: abciximab, eptifibatid, tirofiban, roxifiban og orbofiban anvendes under PCI.
Tabel 5: Trombocythæmmende lægemidler
| Klasse | Middel | Varemærke | Indikation i CCS |
|---|---|---|---|
| NSAID | Acetylsalicylsyre | Aspirin | Alle patienter med CCS bør få aspirin. |
| P2Y12-hæmmere | Ticagrelor | Brilinta, Brilique | Ja, ja |
| Cangrelor | Kengreal | Under PCI | |
| Prasugrel | Effient | Ja | |
| Clopidogrel | Plavix | Ja | |
| GP IIb/IIIA-hæmmere | Tirofiban | Aggrastat | Under PCI |
| Abciximab | ReoPro | Under PCI | |
| Eptifibatide | Integrilin | Under PCI | |
| PAR-1-antagonister | Vorapaxar | Zontivity | Nej |
Aspirin (acetylsalicylsyre)
Anbefaling: Alle patienter med koronar hjertesygdom bør få ≥75 mg aspirin en gang dagligt. Aspirin bruges i DAPT hos alle patienter, der tolererer lægemidlet.
Aspirin reducerer produktionen af TXA2 (tromboxan A2) ved at hæmme COX-1 (cyclooxygenase-1). TXA2 stimulerer blodpladeadhæsion. Man har spekuleret på, om aspirin også kan reducere inflammation og vækst i plak.
Flere skelsættende forsøg har vist, at aspirin er meget effektivt til at forebygge akut myokardieinfarkt. Aspirin er sikkert, veltolereret, billigt og kræver ikke overvågning af hæmostase. Aspirin er indiceret til alle patienter med kronisk og akut koronarsyndrom. Aspirin reducerer risikoen for død og akut myokardieinfarkt med 33 % hos patienter med angina pectoris (ISIS-2, ISIS-3).
En dosis på 75 mg én gang dagligt deaktiverer ca. 80 % af alle blodplader. Undersøgelser viser, at doser i intervallet 75 mg til 1500 mg er lige så effektive med hensyn til at forebygge aterotrombose, men risikoen for dødelige og ikke-dødelige blødninger stiger med højere doser.
Der er ingen data, der understøtter brugen af andre NSAID’er (ibuprofen, naproxen, diclofenac, celecoxib, etoricoxib) til behandling af koronararteriesygdom. COX-1-selektive NSAID’er (celecoxib) kan øge risikoen for kardiovaskulær død (Nissen et al, NEJM).
P2Y12-hæmmere
P2Y12-receptorer er placeret på cellemembranen og stimulerer blodpladeaggregering ved at øge ekspressionen af glykoprotein IIb/IIIa (GP IIb/IIIa)-receptorer. GP IIb/IIIa forbinder blodpladerne via fibrinogen. Hæmning af P2Y12-receptorer resulterer i reduceret ekspression af GP IIb/IIIa.
- Prasugrel: irreversibel hæmning af P2Y12. Leveres som et prodrug, der skal omdannes til sin aktive metabolit i leveren.
- Clopidogrel: reversibel hæmning af P2Y12. Leveres også som et prodrug, der skal omdannes til sin aktive metabolit i leveren.
- Ticagrelor: reversibel hæmning af P2Y12. Ticagrelor har øjeblikkelig virkning.
- Cangrelor: bruges kun under PCI.
Clopidogrel
Clopidogrel 75 mg en gang dagligt svarer til aspirin med hensyn til effekt og sikkerhed. Kliniske forsøg med direkte sammenligning af clopidogrel og aspirin (CAPRIE-studiet) viser, at clopidogrels effekt på akut myokardieinfarkt, iskæmisk slagtilfælde og død er mindst lige så stor som aspiriner.
Clopidogrel omdannes til sin aktive metabolit af cytokrom P450-enzymet CYP2C19. Nogle genetiske varianter i CYP2C19 fører til reduceret omdannelse til den aktive metabolit, hvilket gør clopidogrel mindre effektivt. Genotypebestemmelse er mulig, men anbefales ikke (Knuuti et al, Aradi et al). Omeprazol og esomeprazol hæmmer CYP2C19 og reducerer dermed effekten af clopidogrel.
Anbefalinger:
– Patienter, der har kontraindikationer eller allergi over for aspirin, bør få clopidogrel 75 mg en gang dagligt.
– Clopidogrel bør ikke kombineres med omeprazol eller esomeprazol.
– Clopidogrel kan bruges i DAPT.
Prasugrel
Prasugrel er primært blevet undersøgt hos patienter, der gennemgår PCI. Prasugrel giver en konstant, hurtig og effektiv hæmning af blodpladerne. Prasugrel er mere potent end aspirin og clopidogrel og reducerer risikoen for iskæmiske hændelser under og efter PCI, dog med øget risiko for fatale og ikke-fatale blødninger (Knuuti et al).
Anbefalinger: Hos patienter, der gennemgår elektiv PCI, overvejes prasugrel, hvis tromboserisikoen er høj under eller efter indgrebet, eller hvis DAPT med aspirin og clopidogrel ikke er mulig.
Ticagrelor
Anbefalinger:
– Hos patienter, der gennemgår elektiv PCI, overvejes ticagrelor, hvis tromboserisikoen er høj (f.eks. ugunstige stentresultater eller multivaskulær sygdom), eller hvis DAPT med aspirin og clopidogrel ikke er mulig.
– Ticagrelor kan kombineres med aspirin til DAPT. Patienter, der behandles med OAC (orale antikoagulantia), bør få clopidogrel i stedet for ticagrelor til DAPT.
Ticagrelor er en potent trombocythæmmer med hurtigt indsættende og konstant effekt. Ticagrelor (startdosis på 180 mg, efterfulgt af 90 mg to gange dagligt) er blevet sammenlignet med clopidogrel hos patienter med akut koronarsyndrom med eller uden ST-hævning. Ticagrelor reducerede frekvensen af kardiovaskulær død, myokardieinfarkt og slagtilfælde uden en stigning i risikoen for større blødninger, men med en stigning i frekvensen af ikke-procedurerelaterede blødninger (Wallentin et al, NEJM).
Dyspnø er en almindelig og for det meste forbigående bivirkning af ticagrelor.
DAPT (dobbelt trombocythæmmende behandling)
Anbefaling: DAPT anbefales i løbet af de første 12 måneder efter PCI. Tidligere afslutning af DAPT anbefales, hvis risikoen for blødning opvejer risikoen for trombose.
Patienter med kronisk koronarsyndrom, som gennemgår PCI, er berettiget til DAPT. Aspirin kombineres med en P2Y12-hæmmer i op til 12 måneder efter PCI. Formålet med DAPT er at reducere risikoen for stenttrombose.
Risikoen for stenttrombose falder hurtigt i løbet af de første 30 dage efter PCI. Alligevel anbefales DAPT op til 12 måneder efter PCI. For tidlig afslutning af DATP (<12 måneder) er acceptabelt, hvis risikoen for alvorlig blødning opvejer risikoen for trombose.
Fordelene og farerne ved at fortsætte DAPT efter 12 måneder er stadig uafklarede. PEGASUS-TIMI 54 (Bonaca et al) viste, at ticagrelor-behandling ud over 12 måneder på en baggrund af aspirin reducerede iskæmiske hændelser hos patienter med akut MI, men på bekostning af ikke-dødelige blødninger.
Antikoagulantia
Der er ingen data, der understøtter brugen af antikoagulantia hos patienter med kronisk koronarsyndrom. Undersøgelser har sammenlignet forskellige kombinationer af NOAC (nye orale antikoagulantia) og VKA (vitamin K-antagonister) med blodpladehæmmere. Ingen kombination med OAK er bedre end DAPT. Rivaroxaban (LOWASA, COMPASS, GEMINI-ACS) i tillæg til aspirin og clopidogrel resulterer i færre kardiovaskulære hændelser hos patienter med akut koronarsyndrom, men uden at forbedre den samlede overlevelse.
Stop af orale antikoagulantia og trombocythæmmere før elektive procedurer
- NOAC ‘er bør stoppes 12-48 timer før elektiv PCI.
- K-vitaminagonister (warfarin) kan fortsættes under elektiv PCI.
- Ufraktioneret heparin (UFH) bør administreres under PCI hos patienter på VKA eller NOAC:
- UFH-dosis ved fortsat VKA-behandling: 30-50 U/kg.
- UFH-dosis ved ophør af NOAK: 70-100 U/kg.
- Aspirin bør fortsættes under elektiv hjertekirurgi.
- Prasugrel stopper 7 dage før elektiv kirurgi.
- Clopidogrel stopper 5 dage før elektiv kirurgi.
- Ticagrelol stoppes 3 dage før elektiv kirurgi.
- NOACs (rivaroxaban, apixaban, edoxaban, dabigatran) stoppes 1-2 dage før elektiv kirurgi.
Statiner, ezetemibe og PCSK9-hæmmere
Anbefalinger:
– Alle patienter bør modtage statinbehandling. LDL-kolesterol skal falde ≥50% og til <1,4 mmol/L (<55 mg/dL). Patienter, der har haft trombotiske hændelser inden for 24 måneder, skal behandles til <1,0 mmol/L (<40 mg/dL).
– Ezetimibe tilføjes, hvis statiner ikke er tilstrækkelige til at opnå målniveauer for LDL-kolesterol.
– PCSK9-hæmmere tilføjes, hvis ezetimibe er utilstrækkelig.
Mennesker tåler meget lave kolesterolniveauer. LDL-kolesterol på 0,8 mmol/L (31 mg/dL) anses for at være tilstrækkeligt for et godt helbred. Åreforkalkning opstår ikke ved LDL-kolesterol på 0,5 mmol/L (19 mg/dL) (Libby et al, Robbinson et al).
Det anbefales at sænke lipidniveauerne ved hjælp af kostændringer, motion og vægtkontrol, selvom det er vanskeligt at opnå. Statiner, ezetemibe og PCSK9-hæmmere er potente kolesterolsænkende lægemidler, som primært er rettet mod LDL-kolesterol (Ference et al ). Statiner sænker LDL-kolesterolniveauet gennem hæmning af leverenzymet HMG-CoA-reduktase. Statiner er potente hjertebeskyttende lægemidler med årtiers data, der understøtter deres brede anvendelse (Collins et al.).
Aggressiv statinbehandling kan give regression af aterosklerose, og derfor anbefales højdosis statinbehandling til alle patienter. Grundpillen i statinbehandling er i øjeblikket atorvastatin og rosuvastatin. Simvastatin og pravastatin er mindre potente og giver flere bivirkninger. Lavere doser anbefales til ældre patienter samt patienter med nyre- eller leversvigt.
Opfølgning af statinbehandling er passende 2 måneder efter påbegyndelse af behandlingen. LDL-kolesterol skal falde med mindst 50 % og til <1,4 mmol/L (<55 mg/dL). Patienter, der har haft to trombotiske hændelser inden for 24 måneder, bør behandles til <1,0 mmol/L (<40 mg/dL).
Hvis statiner ikke er tilstrækkelige til at nå målniveauet for LDL-kolesterol, kan ezetimibe tilføjes. Ezetimibe reducerer risikoen for kardiovaskulære hændelser. Ezetimibe kan også give til patienter, som ikke tåler statiner. Ezetimibe er betydeligt dyrere end statiner.
PCSK9-hæmmere (evolocumab og alirocumab) giver en meget effektiv LDL-reduktion og en yderligere reduktion af risikoen for kardiovaskulære hændelser som supplement til statinbehandling. PCSK9-hæmmere påvirker dog ikke overlevelsen og er betydeligt dyrere end statiner og ezetimibe.
JUPITER-forsøget rapporterede, at statiner kan fremkalde diabetes. Efterfølgende delanalyser viste, at statiner fremskynder udbruddet af diabetes (i gennemsnit med 18 måneder) hos personer, der sandsynligvis ville udvikle diabetes uanset statinbehandling (Ridker et al.).
Kostens indvirkning på lipidniveauer
En streng fedtfattig diæt giver en beskeden reduktion af blodfedt og er utilstrækkelig til at styre kolesterolniveauet.
Bevægelse
Alle patienter anbefales 30-60 minutters daglig bevægelse. Bevægelse forbedrer de kardiovaskulære resultater. Kollaterale arterier, endotelfunktion og den aterosklerotiske proces påvirker alle positivt af bevægelse.
Revaskularisering ved stabil angina pectoris
Revaskularisering ved PCI eller CABG (koronar bypass-transplantation) kan forbedre overlevelsen, lindre symptomer, reducere iskæmi, øge funktionsevnen og livskvaliteten hos personer med koronararteriesygdom (Windecker et al., Knuuti et al.). Revaskularisering overvejes, hvis optimal medicinsk behandling ikke er tilstrækkelig til at nå behandlingsmålene, eller hvis prognosen kan forbedres.
Beslutning om revaskularisering kræver funktionel og anatomisk evaluering af kranspulsårerne, hvis formål er at bestemme omfanget og den hæmodynamiske betydning af stenoser. Figur 5 viser det beslutningstræ, som anbefales af European Society for Cardiology.
Valget mellem PCI og CABG kan stadig diskuteres, selvom der er enighed om, at følgende patienter har større gavn af CABG:
- Personer med diabetes.
- Personer over 65 år.
- Personer med multikar-sygdom eller venstre hovedsygdom, især personer med høj risiko.
Med undtagelse af disse tre grupper ser PCI og CABG ud til at være ligeværdige. Tilføjelse af elektiv PCI til OMT hos de resterende patienter giver ikke en overlevelsesfordel (The COURAGE Trial).
Referencer
Knuuti et al: 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal (2019). KNUUTI ET AL ER HOVEDKILDEN TIL DETTE KAPITEL.
Williams RP, Manou-Stathopoulou V, Redwood SR, Marber MS. “Opvarmningsangina”: udnyttelse af fordelene ved motion og myokardieiskæmi. Heart 2014;100:106 114.
Fisher et al: Rapid regression of atherosclerosis: insights from the clinical and experimental literature. Nature Clinical Practice Cardiovascular Medicine volume 5, pages91-102 (2008)Citer denne artikel
Peter Libby et al. Aterosklerose. Nature Reviews Disease Primers bind 5, artikelnummer: 56 (2019).
Juarez-Orozco et al. Indvirkningen af en faldende præ-test-sandsynlighed på udførelsen af diagnostiske tests for koronararteriesygdom. Eur Heart J Cardiovasc Imaging 2019.
Ference et al. Lipoproteiner med lav densitet forårsager aterosklerotisk kardiovaskulær sygdom. 1. Evidens fra genetiske, epidemiologiske og kliniske studier. En konsensusudtalelse fra European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017.
Arbab-Zadeh et al. Akutte koronare hændelser. Circulation (2012).
Collet et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal (2020).
Ibanez et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal (2018).
Collins et al. Fortolkning af evidensen for effekt og sikkerhed ved statinbehandling. The Lancet 2016.
Aradi D et al. Working Group on Thrombosis of the European Society of Cardiology. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014;35:209-215.
Robinson J al. Sikkerhed ved meget lave lipoproteinkolesterolniveauer med alirocumab: poolede data fra randomiserede forsøg. J Am Coll Cardiol. 2017.
Windecker et al. Revaskularisering versus medicinsk behandling hos patienter med stabil koronararteriesygdom: netværksmetaanalyse. BMJ 2014.
Gavazzi et al: Betydningen af walk-through angina-fænomenet under træningstest. Cardiology. 1986;73 (1):47-53.
Mills EJ, Thorlund K, Eapen S, Wu P, Prochaska JJ. Kardiovaskulære hændelser forbundet med farmakoterapier til rygestop: en netværksmetaanalyse. Cirkulation 2014;129:28-41.
Hajek P, Phillips-Waller A, Przulj D, Pesola F, Myers Smith K, Bisal N, Li J, Parrott S, Sasieni P, Dawkins L, Ross L, Goniewicz M, Wu Q, McRobbie HJ. Et randomiseret forsøg med E-cigaretter versus nikotinerstatningsterapi. N Engl J Med 2019;380:629-637.
Shai et al. Weight Loss with a Low-Carbohydrate, Mediterranean, or Low-Fat Diet Liste over forfattere. NEJM 2008.
Dehghan et al. Sammenhængen mellem fedt- og kulhydratindtag og hjerte-kar-sygdomme og dødelighed i 18 lande fra fem kontinenter (PURE): et prospektivt kohortestudie. The Lancet 2017.
Mente et al. Sammenhæng mellem næringsstoffer i kosten og blodlipider og blodtryk i 18 lande: en tværsnitsanalyse fra PURE-undersøgelsen. The Lancet 2017.
Fox K et al. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial (Ivabradin til patienter med stabil koronararteriesygdom og systolisk dysfunktion i venstre ventrikel (BEAUTIFUL): et randomiseret, dobbeltblindt, placebokontrolleret forsøg). Lancet 2008.
Fox K et al: Ivabradine in stable coronary artery disease without clinical heart failure. N Engl J Med 2014;371:1091-1099.