STEMI (myokardieinfarkt med ST-hævning): Diagnose, EKG, kriterier og behandling
STEMI (akut myokardieinfarkt med ST-hævning): Epidemiologi, diagnose (EKG), kriterier og behandling
Akut ST-elevationsmyokardieinfarkt (STEMI) er den mest alvorlige manifestation af koronararteriesygdom. Dette kapitel handler om patofysiologi, definitioner, kriterier og behandling af patienter med akut STEMI. Selvom EKG-forandringer ved akut STEMI er blevet diskuteret tidligere (se EKG-forandringer ved akut myokardieinfarkt), giver der en repetition nedenfor. Håndtering af akut STEMI diskuteres i detaljer nedenfor. De kliniske definitioner og anbefalinger, der præsenteres i dette kapitel, er i overensstemmelse med retningslinjer udstedt af American Heart Association (AHA), American College of Cardiology (ACC) og European Society for Cardiology (ESC). En stor mængde evidens, baseret på randomiserede, kontrollerede kliniske forsøg, understøtter de begreber og anbefalinger, der præsenteres i dette kapitel.
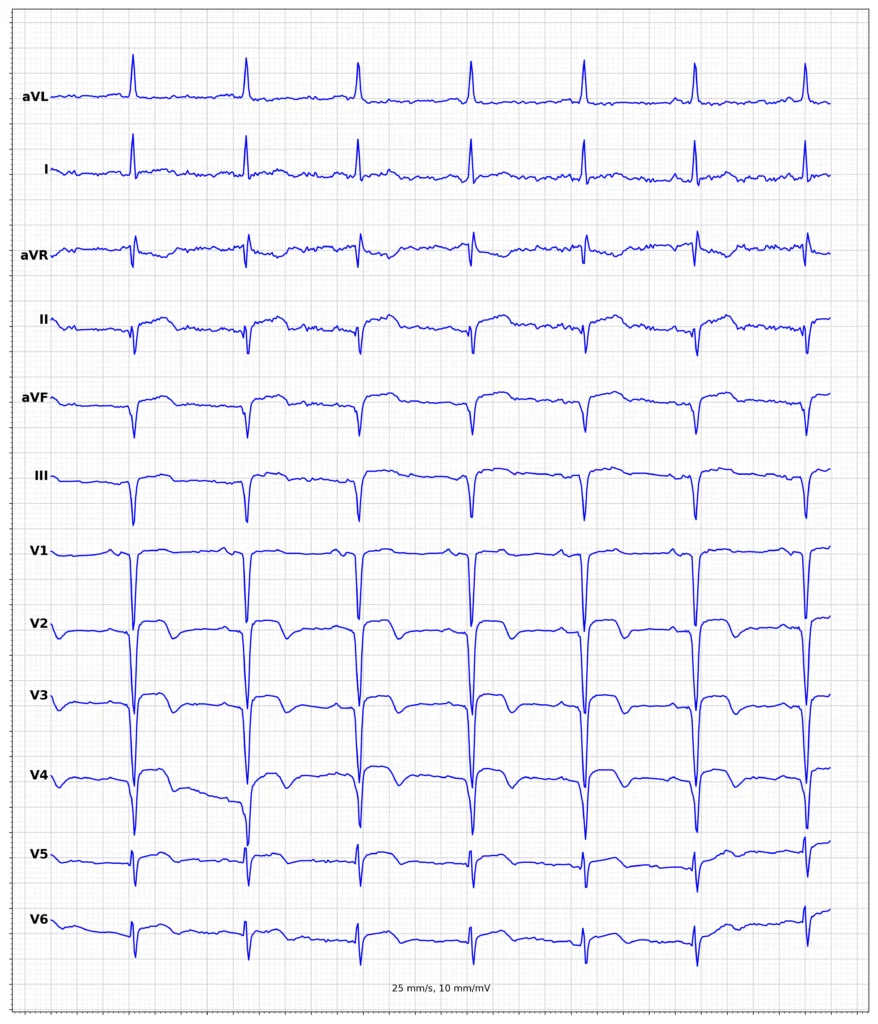
EKG-eksempler på myokardieinfarkt med ST-elevation (STEMI)
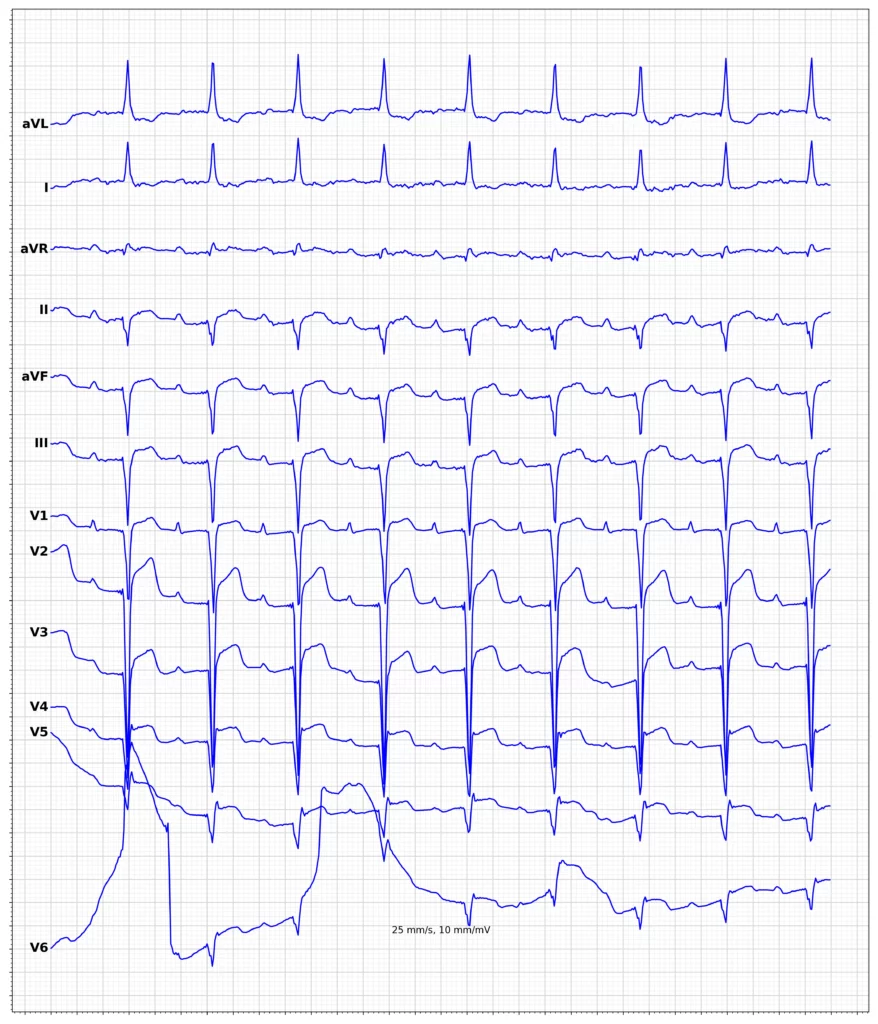
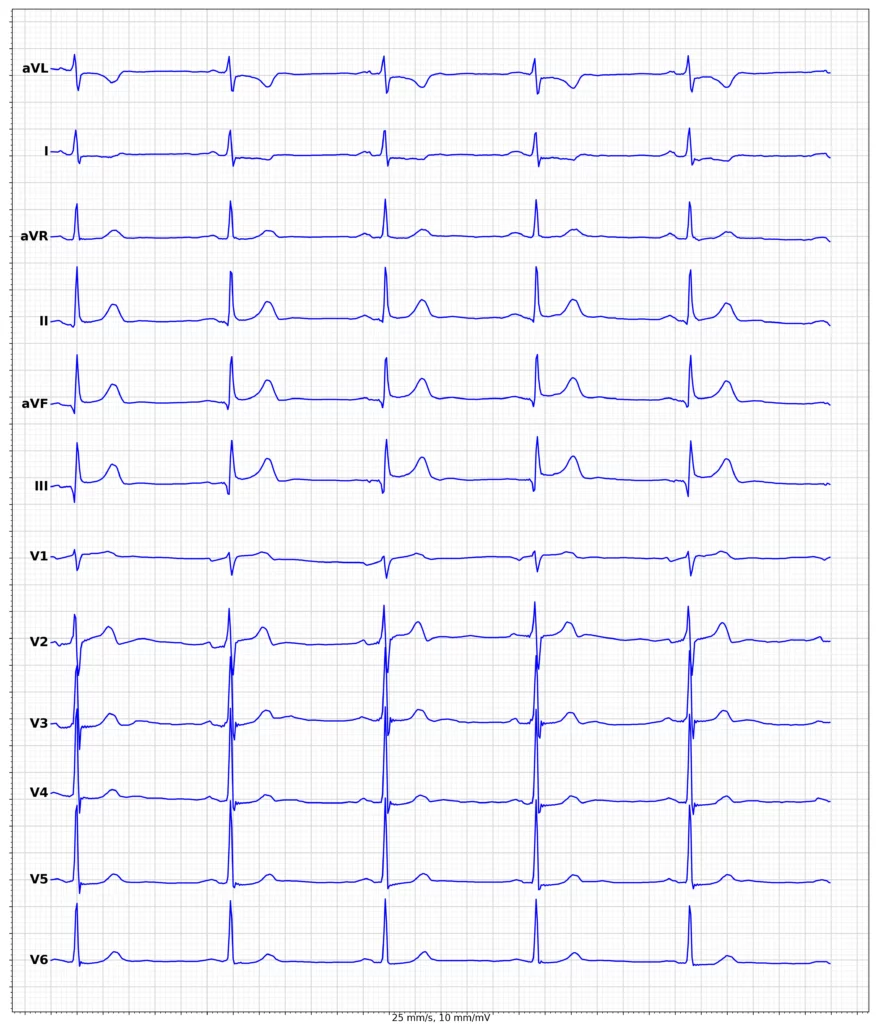
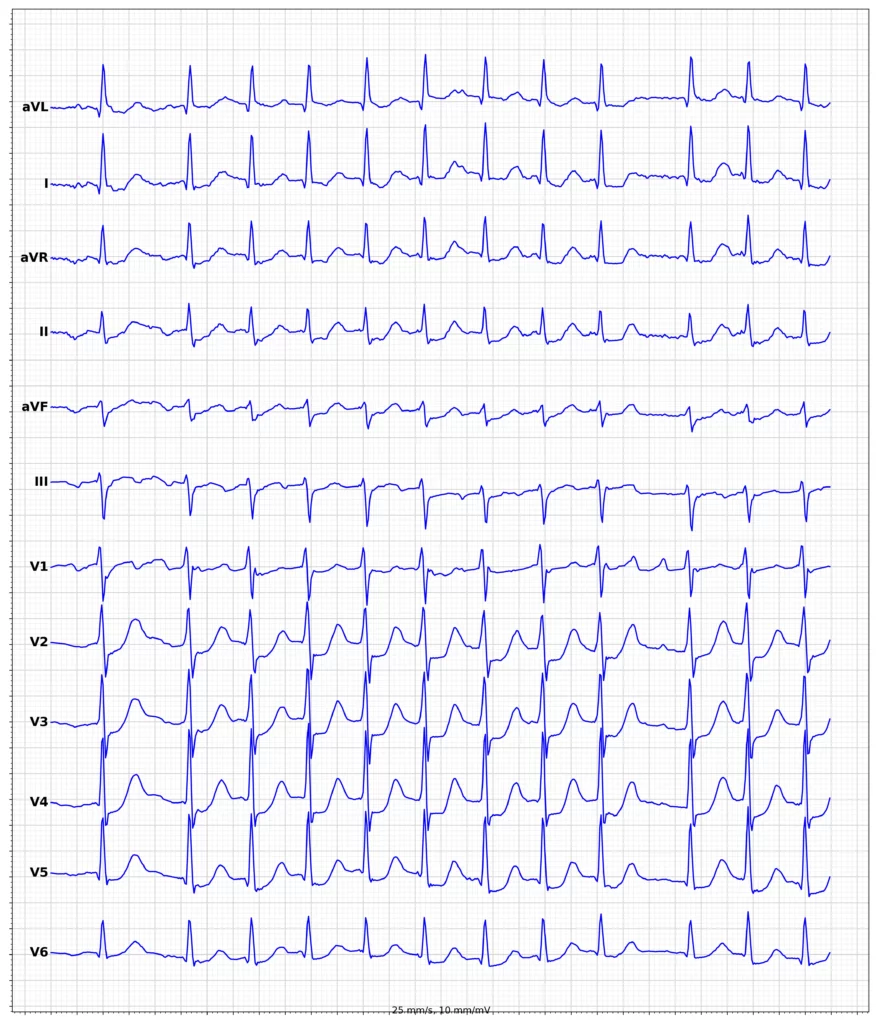
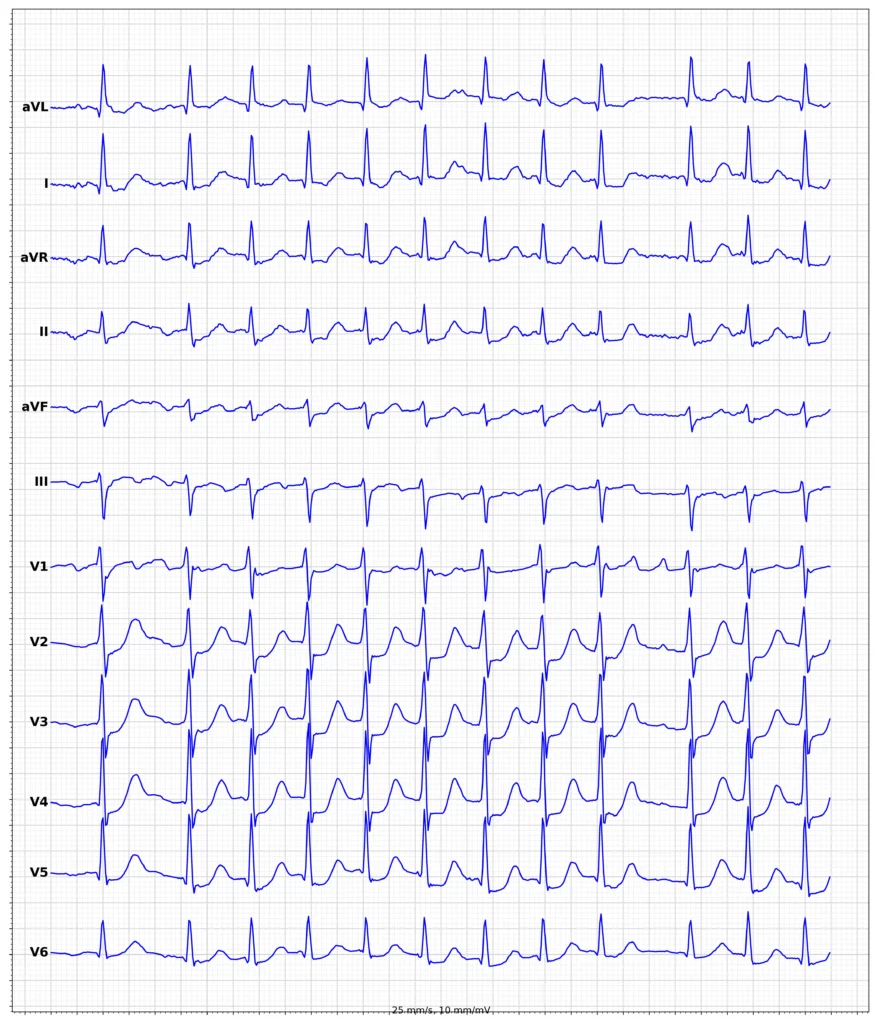
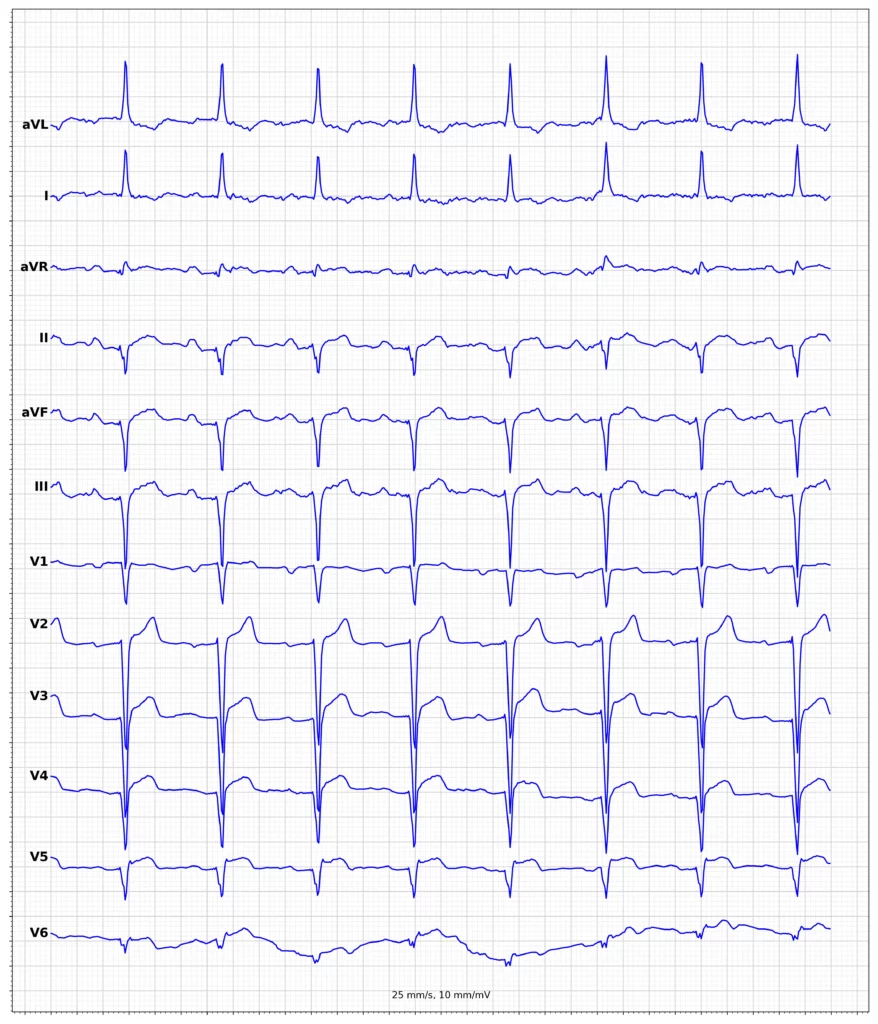
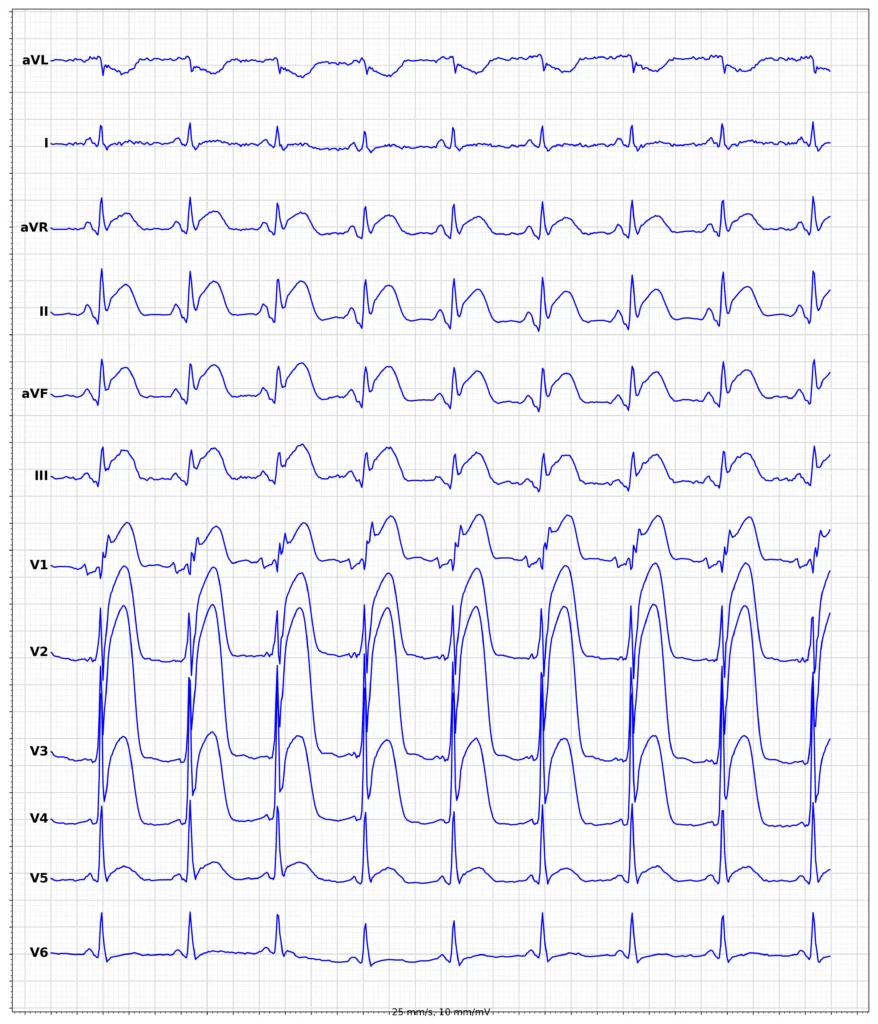
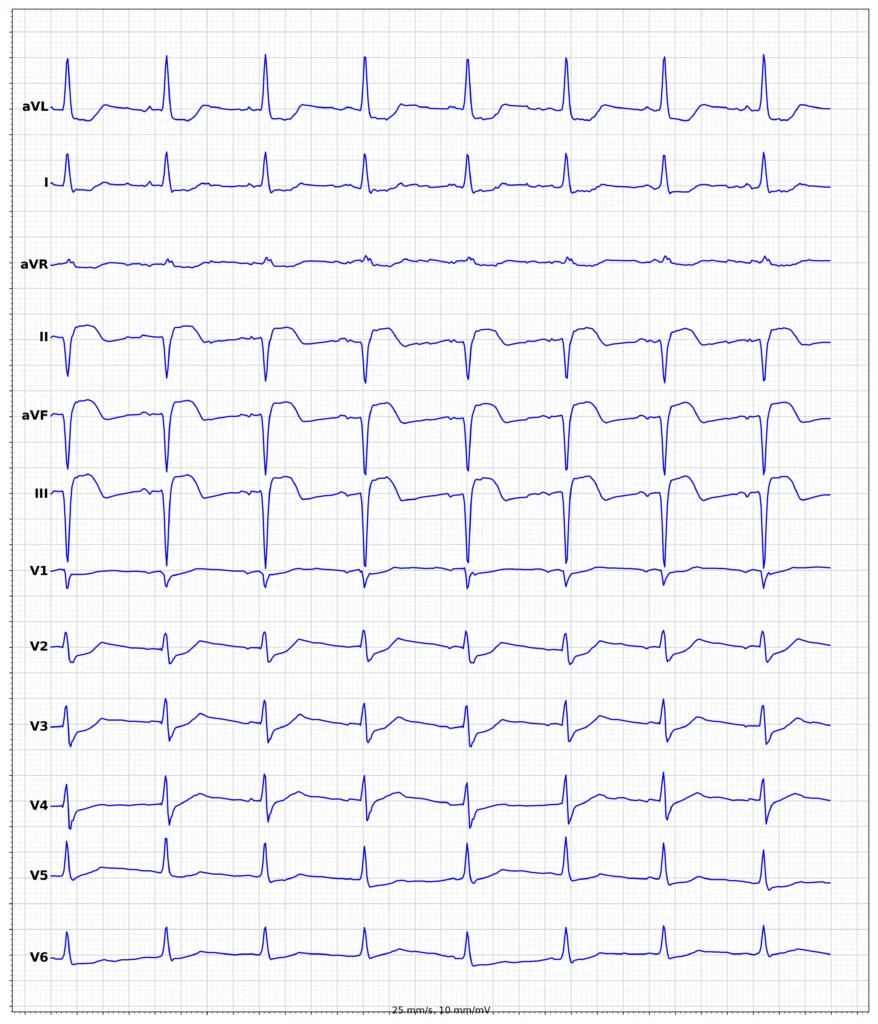
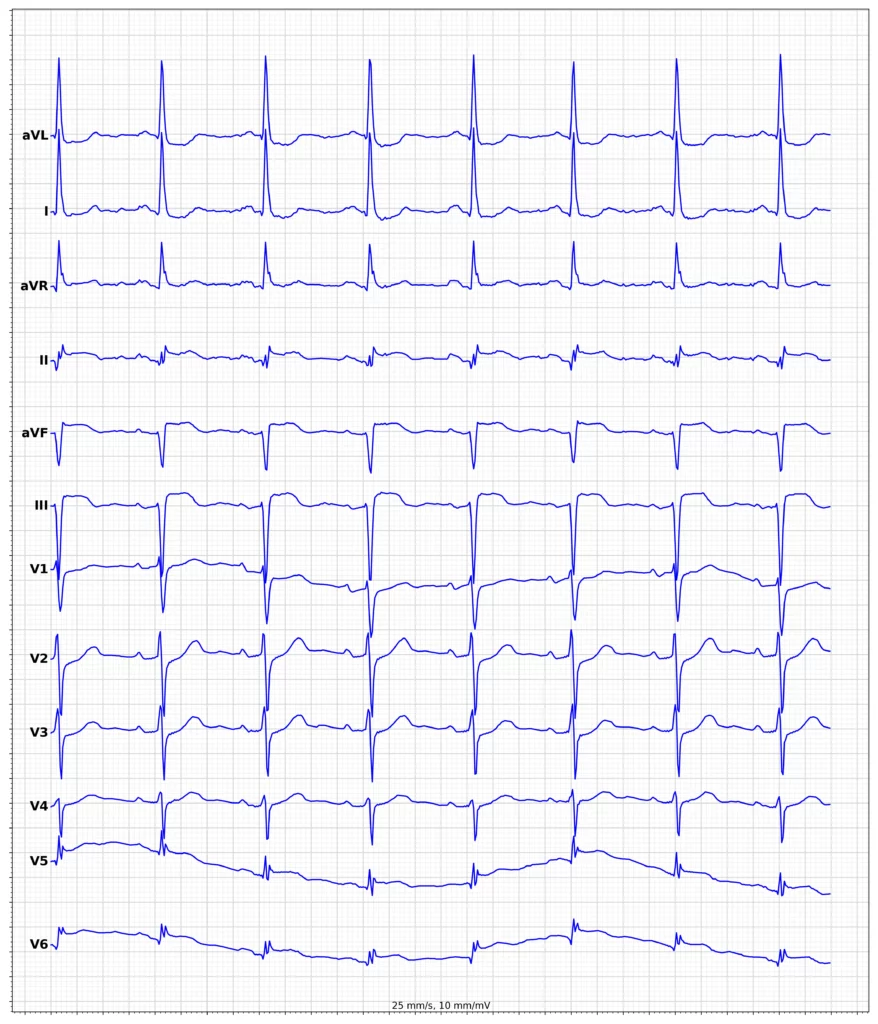
Oversigt over behandling
Klik på diagrammet for at forstørre det.
Brystsmerter (ubehag) er det karakteristiske symptom på myokardieiskæmi og er særligt udtalt hos patienter, der oplever akut STEMI. Sværhedsgraden af symptomerne hos STEMI-patienter sammenlignet med patienter med ikke-ST-elevationsmyokardieinfarkt (NSTEMI) eller ustabil angina (UA) skyldes det større omfang af iskæmi, der er til stede ved STEMI. Ved STEMI fører en komplet okklusion af kranspulsåren til transmural iskæmi, der påvirker en større del af myokardiet og dermed intensiverer brystsmerterne. I modsætning hertil involverer NSTEMI og UA typisk delvise okklusioner, hvilket resulterer i subendokardiel iskæmi og relativt mildere symptomer. Af samme grund har patienter med STEMI større risiko for livstruende ventrikulære arytmier i den akutte fase. Ventrikulær takykardi (VT) og ventrikelflimmer (VF) kan forekomme på ethvert tidspunkt efter okklusion af kranspulsåren. Faktisk er ventrikulær takykardi og ventrikelflimren årsag til langt størstedelen af alle dødsfald i den akutte fase af STEMI. Dødsfald på grund af ventrikulær dysfunktion eller mekaniske komplikationer er langt mindre almindelige i den akutte fase.
Behandlingskæden ved akut STEMI
Optimal behandling af patienter med STEMI kræver et velkoordineret system, der involverer både præhospitale og hospitalsbaserede tjenester. I større samfund er der etableret regionale STEMI-plejesystemer for hurtigt at kunne identificere og håndtere disse patienter. Denne integrerede tilgang er afhængig af et problemfrit samarbejde mellem alarmcentralen, ambulancetjenesten, akutmodtagelsen, kateteriseringslaboratoriet og den kardiologiske afdeling. Hver komponent skal fungere sammenhængende for at sikre rettidig og effektiv behandling. Dette kapitel giver et overblik over hele behandlingskontinuummet, fra præhospital vurdering til udskrivning fra hospitalet.
Diagnosticering af akut STEMI
Diagnosen er ligetil ved hjælp af elektrokardiogrammet (EKG). Præhospitalt personale har vist sig at være i stand til at genkende STEMI ved hjælp af 12-afledningers EKG. EMS-personalets sensitivitet, specificitet, positive prædiktive værdi (PPV) og negative prædiktive værdi (NPV) ved påvisning af STEMI er som følger (Ducas etal., Mencl et al.):
- Sensitivitet: Ambulancepersonalet udviser høj sensitivitet i opsporingen af STEMI, og et studie rapporterer en sensitivitet på 75 %. Således bliver 25 % af STEMI-tilfældene overset af ambulancepersonalet.
- Specificitet: Specificiteten er relativt lav med 53 %, hvilket understreger udfordringerne ved at skelne mellem STEMI og tilstande, der efterligner STEMI.
- Positiv prædiktiv værdi (PPV): PPV er 59,5 %, hvilket indikerer, at lidt over halvdelen af de tilfælde, der identificeres som STEMI af EMS, er ægte positive.
- Negativ prædiktiv værdi (NPV): NPV er usædvanlig høj med 99,7 %, hvilket tyder på, at ambulancepersonalet er meget pålidelige, når det gælder om at udelukke STEMI, når det ikke er til stede.
Dette understreger EMS-personalets styrker og begrænsninger i præhospital STEMI-identifikation og understreger deres evne til effektivt at udelukke STEMI, mens de står over for udfordringer med at bekræfte diagnosen. Det er vigtigt, at patienter, der bruger ambulancepersonalet, kan få bedre resultater, da flere evidensbaserede behandlinger (herunder reperfusion) kan påbegyndes i præhospitalet.
Måling af hjertetroponiner er ikke påkrævet for at diagnosticere akut STEMI, da diagnosen er baseret på den kliniske præsentation (især brystsmerter) og ST-segmentforhøjelser på EKG’et. Hjertetroponiner analyseres dog rutinemæssigt, så snart den kliniske situation tillader det.
Generelle principper for behandling
Behandling af STEMI involverer en kombination af antiiskæmiske midler, trombocythæmmende behandling, antikoagulantia og reperfusionsstrategier, såsom perkutan koronar intervention (PCI) eller fibrinolyse. Reperfusionsbehandling er afgørende og skal iværksættes omgående, da akut STEMI skyldes fuldstændig arteriel okklusion, som kræver øjeblikkelig genoprettelse af blodgennemstrømningen. Næsten alle patienter med akut STEMI bør henvises til kateteriseringslaboratoriet med henblik på koronarangiografi med det formål at udføre PCI. Antitrombotisk behandling, herunder trombocythæmmende midler, antikoagulantia og reperfusionsindgreb, reducerer dødeligheden betydeligt ved at forhindre trombeprogression og genoprette koronararteriens åbenhed, hvilket i sidste ende forbedrer myokardieperfusionen og patientresultaterne. En oversigt over reperfusionsstrategier er vist i figur 1.
Diagnose og definition af akut STEMI (myokardieinfarkt med ST-elevation)
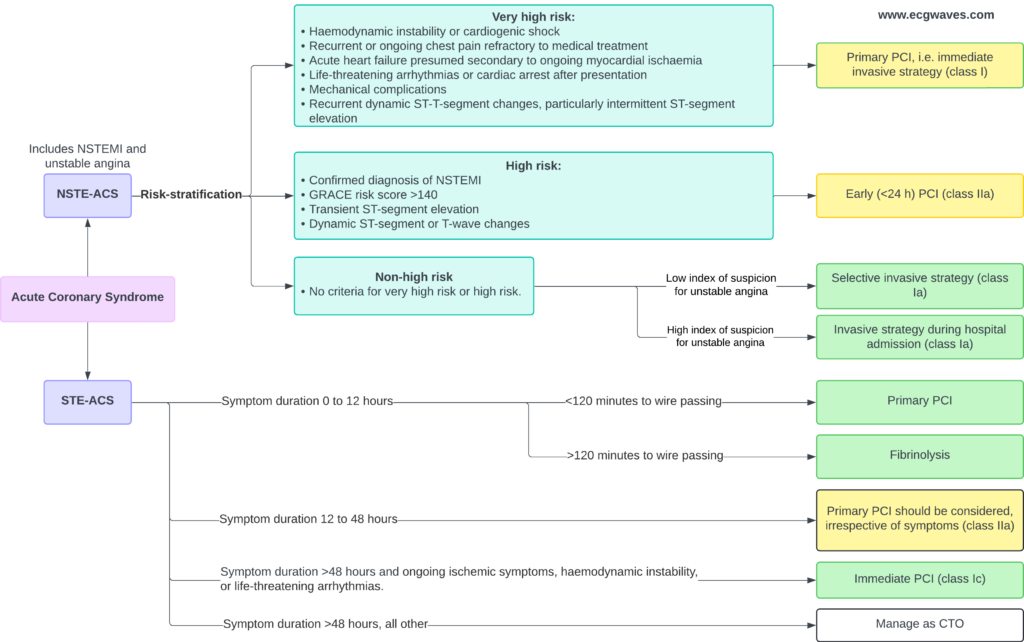
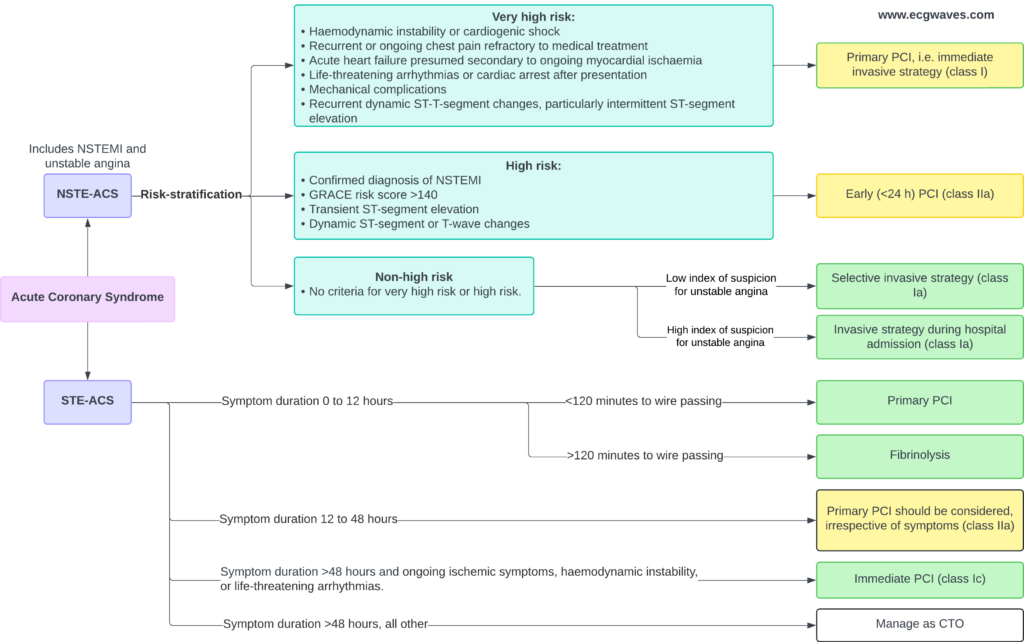
ST-elevationsmyokardieinfarkt (STEMI) er et akut koronart syndrom (ACS). Der findes to typer af akut koronarsyndrom:
- STE-ACS (ST Elevation Acute Coronary Syndrome) er defineret ved tilstedeværelsen af signifikante ST-segmentforhøjelser på EKG. Hvis en patient med sådanne EKG-ændringer udvikler myokardieinfarkt (defineret ved forhøjede troponinniveauer i blodet), klassificeres tilstanden som STEMI (ST Elevation Myocardial Infarction). STEMI diagnosticeres først, når forhøjede troponinniveauer er blevet bekræftet; indtil da klassificeres tilstanden som STE-ACS. I klinisk praksis er STE-ACS og STEMI dog ækvivalente, fordi stort set alle patienter med brystsmerter og ST-elevationer på EKG vil have forhøjede troponinniveauer.
- NSTE-ACS (Non ST Elevation Acute Coronary Syndrome) er defineret ved fravær af ST-elevationer på EKG. Alle patienter, der ikke opfylder kriterierne for STEMI, vil automatisk blive klassificeret som NSTE-ACS. Størstedelen af disse patienter vil udvise forhøjede troponinniveauer, hvilket klassificerer tilstanden som NSTEMI (Non ST Elevation Myocardial Infarction). De, der ikke har forhøjede troponinniveauer, klassificeres som ustabil angina pectoris (UA). Patienter med NSTE-ACS har typiske ST-sænkninger og/eller T-bølge-inversioner.
Denne klassificering af akutte koronarsyndromer er illustreret i figur 2.
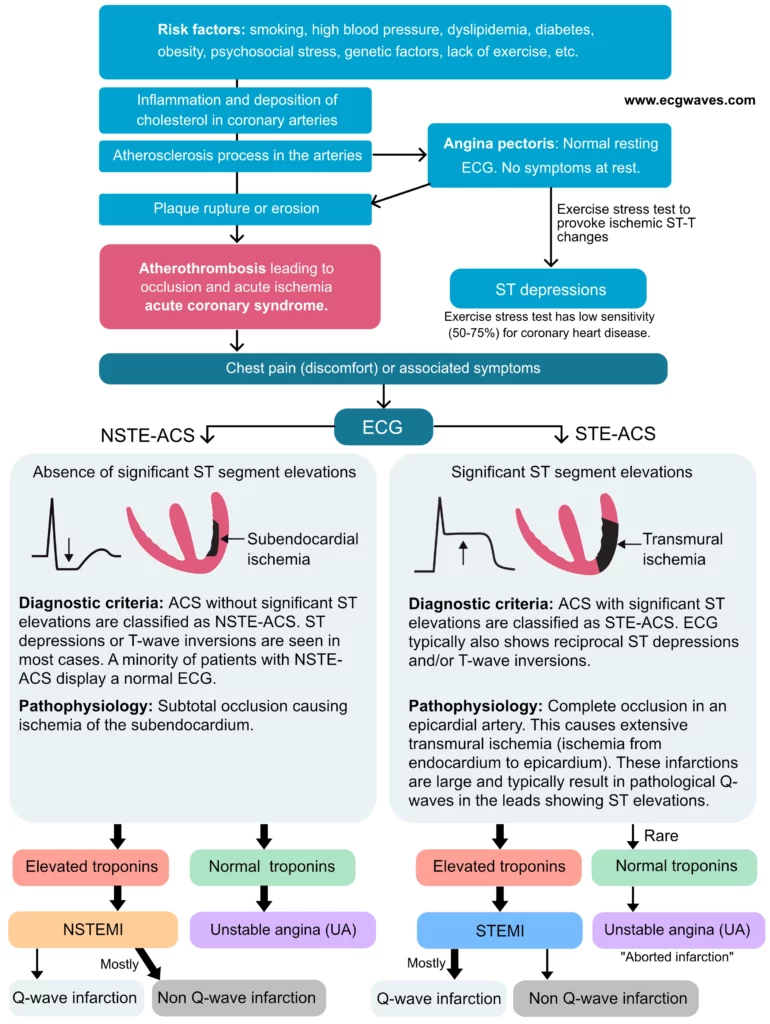
Kort sagt kræver diagnosen akut myokardieinfarkt (AMI) tegn på myokardienekrose, hvilket indikerer af forhøjede troponinniveauer. Sondringen mellem akut koronarsyndrom med ST-elevation (STE-ACS eller STEMI) og akut koronarsyndrom uden ST-elevation (NSTE-ACS, som omfatter NSTEMI og ustabil angina) ligger i tilstedeværelsen af ST-segmentforhøjelser på EKG’et. Selv om denne klassifikation kan virke noget arbitrær, skelner den effektivt mellem to forskellige tilstande med hensyn til trombose i kranspulsårerne. Disse tilstande kræver skræddersyede behandlingsmetoder for at optimere patienternes overlevelse og resultater.
Patofysiologi ved STE-ACS (akut koronarsyndrom med ST-elevation) og STEMI (myokardieinfarkt med ST-elevation)
STEMI er et klinisk syndrom, der er kendetegnet ved symptomer på myokardieiskæmi – især brystsmerter eller ubehag – ledsaget af ST-segmentforhøjelser på EKG’et og forhøjede troponinniveauer. Som nævnt vil næsten alle patienter med kliniske tegn på myokardieiskæmi (f.eks. brystsmerter) og ST-segmentforhøjelser også have forhøjede troponinniveauer, hvilket gør akut koronarsyndrom med ST-elevation (STE-ACS) klinisk synonymt med STEMI. Som illustreret i figur 1 skyldes STEMI en trombose placeret proksimalt i en koronararterie. Tromben er typisk stor nok til at forårsage en fuldstændig okklusion, der blokerer blodgennemstrømningen i arterien. Det fører til alvorlig iskæmi i det myokardium, der forsynes af den ramte arterie og dens forgreninger. Iskæmien er transmural, hvilket betyder, at den involverer hele tykkelsen af myokardievæggen, fra endokardiet til epikardiet (Figur 3).
Video 1 og Video 2 viser obstruktionen af blodgennemstrømningen hos en patient med STEMI (Video 1) og resultatet af PCI (Video 2).
Video 1 (foroven): Dette angiogram viser et kateter placeret i det venstre cirkumfleks-koronararterie. Arterien er okkluderet og derfor ikke fyldt med kontrast.
Video 2 (ovenfor): Den samme patient efter ballonopblæsning og placering af en stent. Flow kan nu visualiseres i arterien (Todt et al).
Epidemiologi for myokardieinfarkt med ST-elevation
Forekomsten af STEMI
I 1990 udgjorde STEMI næsten 50 % af alle tilfælde af akut koronarsyndrom (ACS). Siden da er forekomsten af STEMI faldet støt, og i de senere år har det udgjort ca. 25-40 % af alle tilfælde af akut myokardieinfarkt (AMI). Omvendt er forekomsten af NSTEMI steget, hvilket sandsynligvis kan tilskrives den øgede følsomhed af moderne troponinanalyser, der gør det muligt at opdage mindre myokardieskader (Martin et al.).
Dødelighed ved STEMI
Dødeligheden ved STEMI er også faldet drastisk i de seneste årtier. Dødeligheden på hospitalet er i øjeblikket 5 %, og 1-års dødeligheden er 7-18 %. Omkring 70 % af patienterne med STEMI er mænd. Kvinder har på den anden side en længere forsinkelse fra symptomdebut til første lægekontakt, og kvinder er også mindre tilbøjelige til at modtage evidensbaserede interventioner, såsom PCI og fibrinolyse. Det kan til en vis grad forklares med, at kvinder har tendens til at have atypiske symptomer oftere end end mænd (Smilowitz et al.). Næsten hver fjerde patient med STEMI har diabetes, hvilket også giver en øget risiko for komplikationer (f.eks. hjertesvigt) og død (både i den akutte situation og på lang sigt). Ældre og patienter med nyresygdom er også mindre tilbøjelige til at modtage anbefalede interventioner, på trods af at der er bevis for, at sådanne foranstaltninger er gavnlige.
Akutte og langsigtede komplikationer ved akut STEMI
Akut myokardieinfarkt, især STEMI, kan føre til flere akutte og langsigtede komplikationer, hver med potentielt alvorlige konsekvenser. Livstruende arytmier som ventrikulær takykardi og ventrikelflimren kan opstå når som helst efter okklusionen af kranspulsåren, med størst risiko i løbet af de første par timer. Disse iskæmi-inducerede arytmier er ansvarlige for størstedelen af dødsfaldene i den akutte fase, men deres sandsynlighed falder betydeligt efter ca. 6 timer. Risikoen for farlige arytmier fortsætter i tilfælde med omfattende myokardieinfarkt, især når det ledsages af hjertesvigt, som kan udløse kronisk myokardieombygning. Denne remodelleringsproces kan efterfølgende føre til ventrikulære arytmier på lang sigt. Mekaniske komplikationer udgør også en betydelig risiko efter AMI. Den hyppigste er papillarmuskelruptur, som kan forårsage kardiogent chok. Selvom det er mindre almindeligt, kan ruptur af septum interventricularis eller venstre ventrikels frie væg forekomme og er ofte dødelig. Derudover ses der ofte iskæmiske bradyarytmier, især i tilfælde af inferiore infarkter.
Papillarmuskelruptur (PMR) ved akut myokardieinfarkt
Papillarmuskelruptur (PMR) forekommer hos ca. 1 % af patienterne efter akut myokardieinfarkt (AMI). Det udvikler sig typisk inden for 2 til 7 dage efter infarktet. Den posteromediale papillarmuskel rammes hyppigst og har 10 gange større risiko for at briste end den anterolaterale papillarmuskel. Denne sårbarhed tilskrives dens eneste blodforsyning, som normalt kommer fra højre kranspulsåre eller venstre circumflex-arterie. Patienter med PMR har som regel pludselig opstået alvorlig mitralinsufficiens, som fører til lungeødem, hypotension og kardiogent chok. En ny systolisk mislyd kan opdages, selvom den kan være fraværende i tilfælde af fuldstændig ruptur eller betydelig dysfunktion i venstre ventrikel. Tidligt kirurgisk indgreb, oftest udskiftning af mitralklappen, er afgørende for overlevelse, selv om resultaterne fortsat er dårlige.
EKG ved akut STEMI (myokardieinfarkt med ST-elevation)
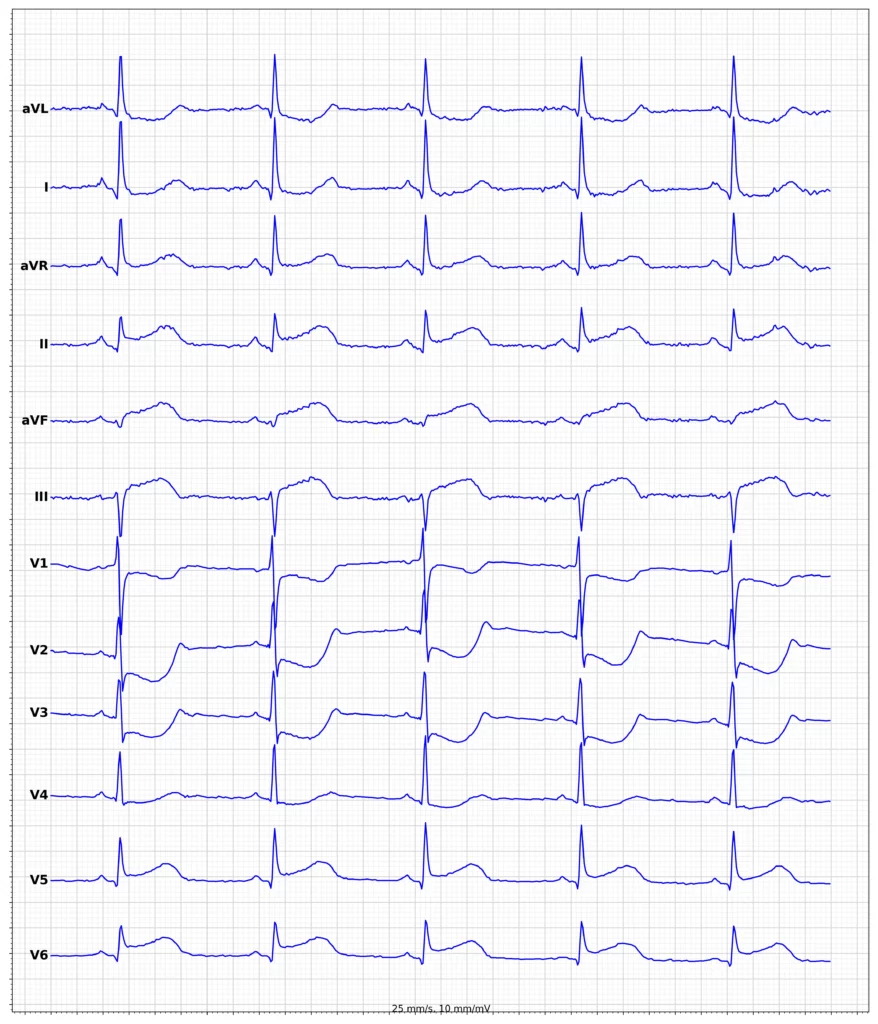
EKG’et er nøglen til at diagnosticere STEMI. EKG-kriterier for STEMI anvendes ikke ved tilstedeværelse af venstre grenblok (LBBB) eller venstre ventrikelhypertrofi (LVH), fordi disse tilstande forårsager sekundære ST-T-forandringer, som kan maskere eller simulere iskæmiske ST-T-forandringer. ST-segmentforhøjelse måles i J-punktet, og forhøjelsen skal være signifikant i mindst 2 sammenhængende EKG-afledninger. Sammenhængende afledninger henviser til afledninger, der er direkte naboer og afspejler det samme anatomiske område; såsom forreste afledninger (V1-V6), nedre afledninger (II, aVF, III) og laterale afledninger (I, aVL). For eksempel er afledningerne V3 og V4 sammenhængende; V1 og V2 er også sammenhængende; aVL og I er også sammenhængende; V3 og V5 er ikke sammenhængende, fordi afledning V4 er placeret mellem disse afledninger.
J-punktsforhøjelse på ≥1 mm betragtes som signifikant i alle afledninger undtagen V2 og V3. Dette skyldes, at de fleste kvinder og mænd udviser en let ST-hævning (J-punktshævning) i V2 og V3, hvorfor der kræves en højere J-punktshævning i disse afledninger. Se panel 1 for alle EKG-kriterier for STEMI.
Panel 1: EKG-kriterier til diagnosticering af akut STEMI
- Nye ST-segmentforhøjelser i mindst to anatomisk sammenhængende afledninger:
- Mænd ≥40 år: ≥2 mm i V2-V3 og ≥1 mm i alle andre afledninger.
- Mænd <40 år: ≥2,5 mm i V2-V3 og ≥1 mm i alle andre afledninger.
- Kvinder (alle aldre): ≥1,5 mm i V2-V3 og ≥1 mm i alle andre afledninger.
- Mænd og kvinder V4R og V3R: ≥0,5 mm, bortset fra mænd <30 år, hvor kriteriet er ≥1 mm.
- Mænd og kvinder V7-V9: ≥0,5 mm.
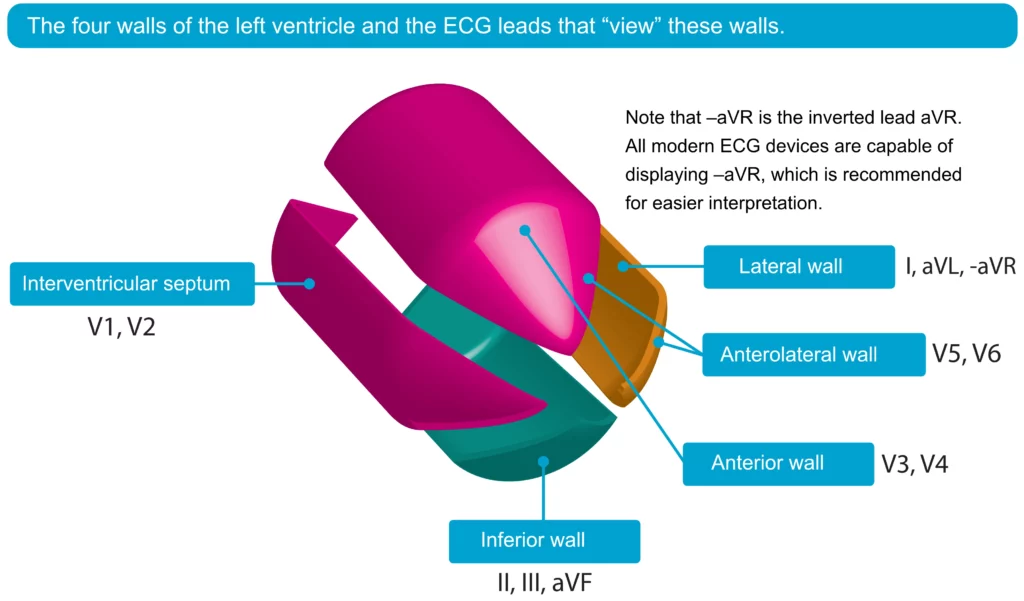
Hos patienter med STEMI svarer de EKG-afledninger, der viser ST-segmentforhøjelser, til det iskæmiske område af myokardiet. For eksempel indikerer ST-elevationer i afledning V3 og V4 (anteriore brystafledninger) anterior iskæmi, mens ST-elevationer i afledning aVF og II antyder inferior iskæmi. Figur 5 giver en visuel fremstilling af venstre ventrikels fire vægge og de specifikke EKG-afledninger, der afspejler disse myokardieregioner, hvilket hjælper med at lokalisere det iskæmiske område.
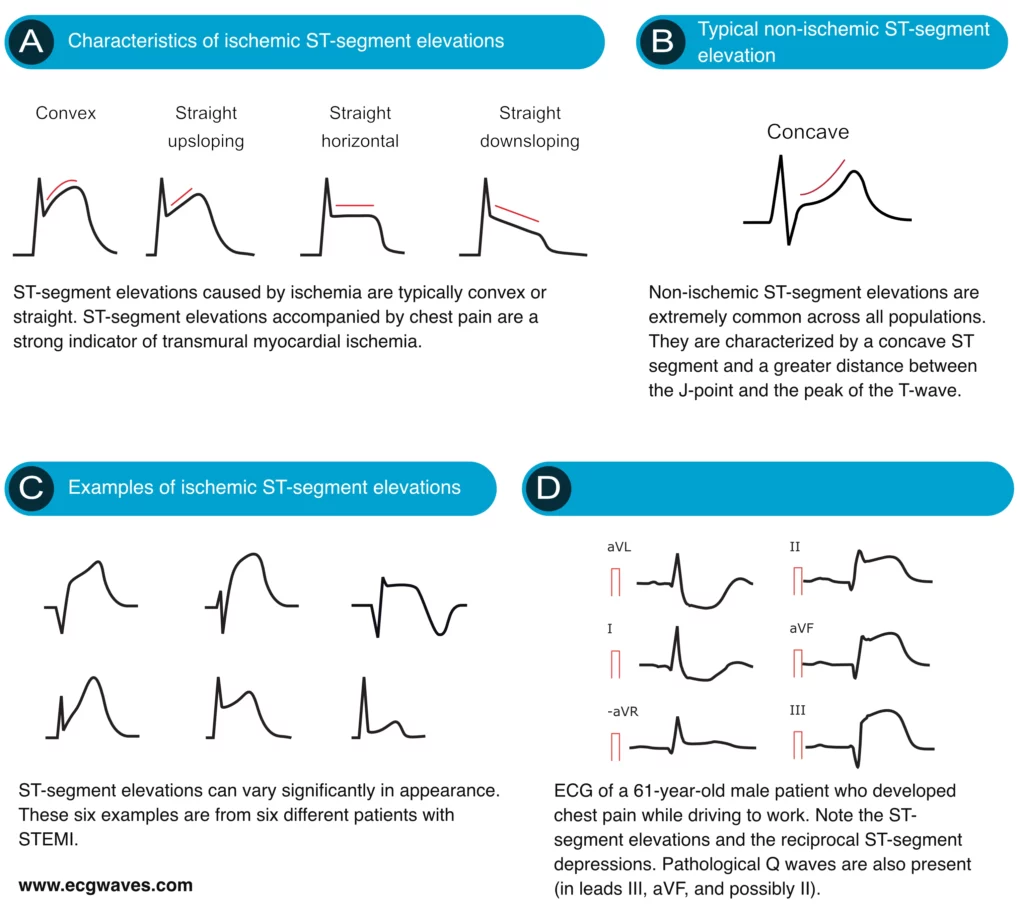
Karakteristika for iskæmiske ST-elevationer
ST-elevationer med lige (vandret, op- eller nedadgående) eller konvekse ST-segmenter tyder stærkt på akut STEMI (Figur 6A). Konkave ST-segmentforhøjelser er på den anden side mindre tilbøjelige til at være forårsaget af iskæmi (Figur 6B). Dette bemærkes i både nordamerikanske og europæiske retningslinjer. Et konkavt ST-segment udelukker dog ikke STEMI, det reducerer kun sandsynligheden for STEMI.
Andre årsager til forhøjet ST-segment
Med hensyn til differentialdiagnostik kan mindst 16 andre tilstande også forårsage ST-elevationer. Disse tilstande er blevet diskuteret i detaljer i artiklen ST-elevationer ved iskæmi, infarkt og differentialdiagnoser. Nogle af disse tilstande er godartede, mens andre er potentielt livstruende.
Panel 2. Differentialdiagnoser af ST-elevationer
- Mandligt/kvindeligt mønster (“Normal ST-segmentforhøjelse”)
- Tidligt repolariseringssyndrom
- Venstre ventrikelhypertrofi (LVH)
- Venstre bundt grenblok (LBBB)
- Akut perikarditis (myokarditis, perimyokarditis)
- Hyperkaliæmi
- Brugadas syndrom
- Lungeemboli
- Dissektion af aorta
- Arytmogen højre ventrikel kardiomyopati (dysplasi) – ARVD/ARVC
- Præeksitation (Wolff-Parkinson-White syndrom)
- Elektrisk kardioversion
- Takotsubo-kardiomyopati (knust hjerte-syndrom, apikal ballooning-syndrom)
- Prinzmetals angina (variantangina, vasospasme i koronararterien)
- Hypotermi og hyperkalcæmi
- Venstre ventrikel aneurisme
Gensidige ST-sænkninger, T-bølge-inversioner (negative T-bølger) og patologiske Q-bølger ved STEMI
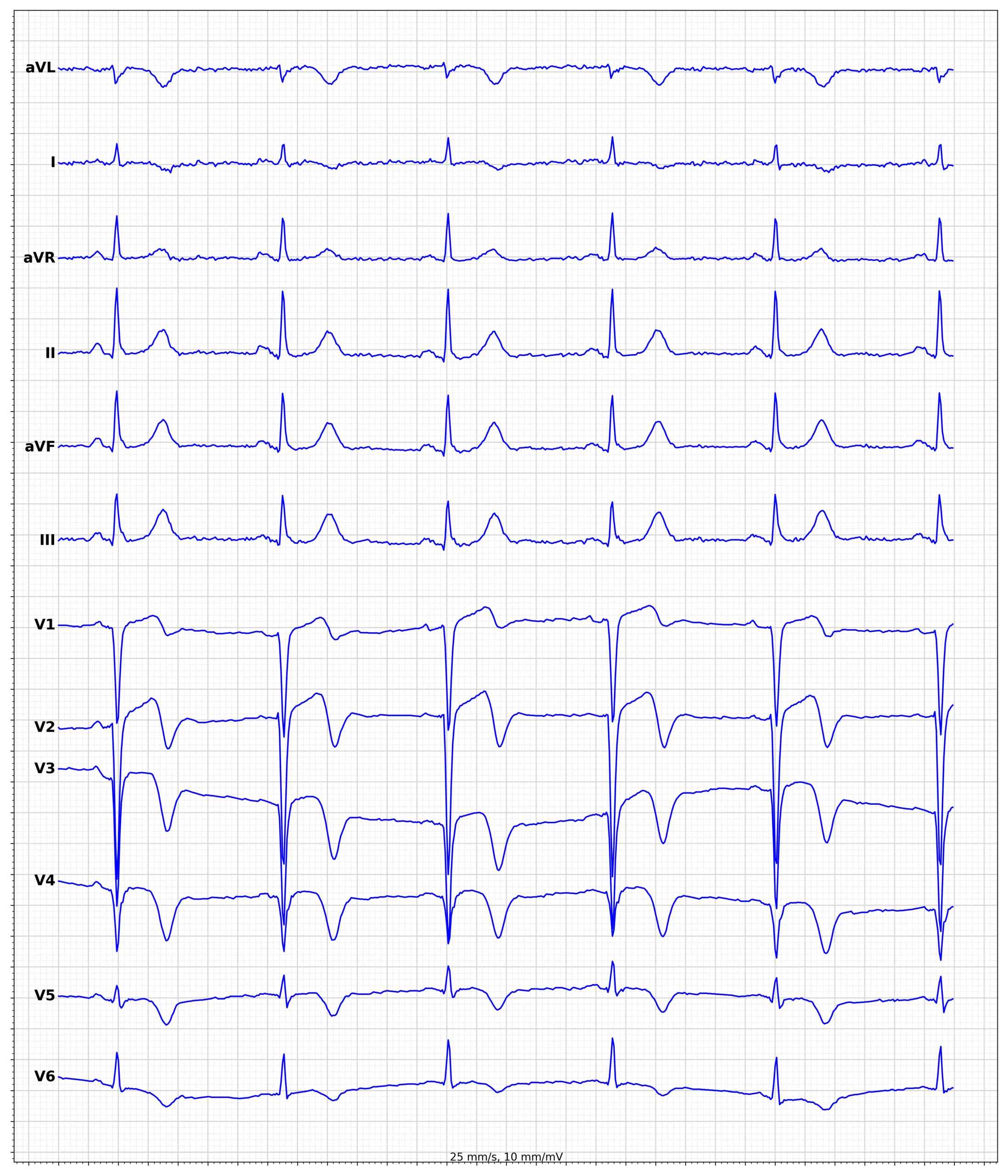
I de fleste tilfælde ledsages ST-hævningerne af reciprokke ST-sænkninger. Sådanne ST-sænkninger er spejlbilleder af ST-hævningerne og forekommer derfor i afledninger, der er i den modsatte vinkel i forhold til de afledninger, der viser ST-hævninger. Figur 7 viser til patienter med akut STEMI, og der er tydelige reciprokke ST-depressioner i begge tilfælde.
Hos patienter med STEMI normaliseres ST-segmentforhøjelserne gradvist (inden for 15 timer) og efterfølges af T-bølgeinversioner, som kan vare ved i en måned eller længere. Patologiske Q-bølger kan forekomme, hvis infarktområdet er stort (størstedelen af STEMI-patienter udvikler sådanne Q-bølger). Disse Q-bølger er unormalt brede og dybe (figur 7). De vidner om, at infarktet var omfattende. Infarkter, der resulterer i patologiske Q-bølger, kaldes Q-bølge-infarkter.
Aborteret myokardieinfarkt (MI)
I sjældne tilfælde kan tromben opløses (enten spontant eller ved hjælp af reperfusionsbehandling), før infarktprocessen begynder. I sådanne tilfælde er troponinniveauet ikke forhøjet, og tilstanden klassificeres som ustabil angina pectoris eller aborteret myokardieinfarkt. Dette er dog sjældent, og stort set alle tilfælde af STE-ACS udvikler sig til STEMI.
Særlige overvejelser
EKG’et kan være misvisende hos nogle patienter med akut transmural iskæmi. Nogle patienter har f.eks. underliggende EKG-abnormiteter (f.eks. LBBB), som gør det meget vanskeligt at opdage iskæmiske EKG-forandringer. Andre patienter kan have akut transmural iskæmi i områder, der ikke registreres af nogen af de 12 standardafledninger. Disse omstændigheder diskuteres nedenfor.
Venstre grenblok (LBBB) hos patienter med akut STEMI
Venstre bundtgrenblok (LBBB) opstår, hvis den venstre bundtgren er dysfunktionel og dermed ude af stand til at lede den elektriske impuls til venstre ventrikel. Aktiveringen af den venstre ventrikel vil afhænge af de impulser, der spredes fra den højre ventrikel. Dette resulterer i unormal aktivering (depolarisering) og gendannelse (repolarisering) af venstre ventrikel. Unormal repolarisering resulterer i udtalte ST-T-forandringer, herunder ST-hævninger (afledning V1-V3), ST-sænkninger (afledning V4, V5, V6, aVL, I) og inverterede T-bølger (afledninger med ST-sænkninger). Disse ST-T-ændringer er illustreret i figur 6. Bemærk, at disse ST-T-ændringer altid er normale og forventede hos patienter med LBBB.
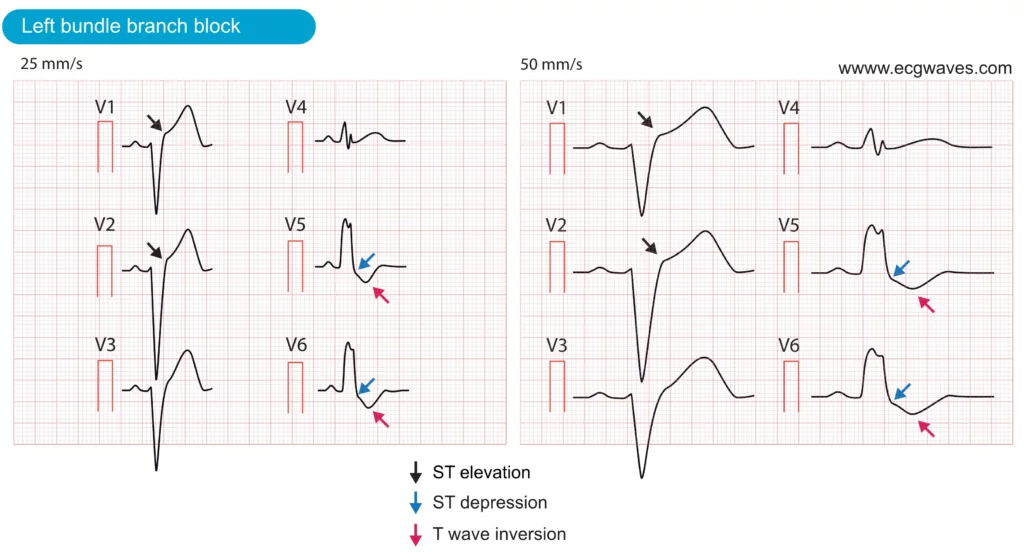
Der er tre grunde til, at LBBB komplicerer vurderingen af patienter med mistanke om akut myokardieinfarkt:
- Venstre grenblok (LBBB) kan efterligne akut STEMI, da det ofte præsenteres med lignende EKG-forandringer, herunder ST-segmentforhøjelser, ST-segment-sænkninger og T-bølge-inversioner. Disse overlappende træk fører ofte til forveksling mellem LBBB og akut STEMI. Faktisk har undersøgelser vist, at LBBB er den mest almindelige årsag til falske aktiveringer af kateteriseringslaboratoriet.
- LBBB kan maskere (skjule) igangværende iskæmi: LBBB forårsager alvorlig forstyrrelse af ventrikulær repolarisering, hvilket normalt forhindrer andre ST-T-forandringer (såsom dem, der skyldes iskæmi) i at komme til udtryk på EKG. Derfor skjules iskæmiske ST-T-forandringer (ST-hævninger, ST-sænkninger, T-bølgeforandringer) typisk i forbindelse med LBBB. En patient med akut STEMI kan derfor udvise et normalt LBBB-mønster.
- LBBB kan være forårsaget af iskæmi/infarkt: Der er mange årsager til LBBB, f.eks. hjertesvigt, strukturelle hjertesygdomme, fibrose i ledningssystemet og akut myokardieinfarkt (især anterior STEMI). Derfor kan et akut myokardieinfarkt faktisk resultere i LBBB, som så maskerer de iskæmiske ST-T-forandringer på EKG’et.
Sammenfattende kan venstre grenblok (LBBB) være resultatet af, efterligne eller skjule akut myokardieiskæmi og -infarkt, hvilket skaber betydelige diagnostiske udfordringer. Denne kompleksitet fik forskere til at undersøge patienter med LBBB og mistanke om akut myokardieinfarkt (AMI) ved at henvise dem til akut reperfusionsbehandling, som på det tidspunkt primært var fibrinolyse (Wilner et al.). Deres resultater viste, at et stort antal af disse patienter havde komplette okklusioner af kranspulsårerne, og at resultaterne blev bedre, når de blev behandlet som akutte STEMI-tilfælde.
I mange år anbefalede europæiske og nordamerikanske retningslinjer at behandle patienter med symptomer på myokardieiskæmi og ny (eller formodet ny) LBBB som akut STEMI. Efterfølgende undersøgelser viste dog, at denne tilgang førte til et uacceptabelt højt antal unødvendige aktiveringer af kateteriseringslaboratorier. Derfor anbefaler de seneste nordamerikanske retningslinjer (O’Gara et al.), at nye (eller formodede nye) LBBB ikke bør betragtes som diagnostiske for AMI i sig selv. I stedet bør patienter med en høj klinisk mistanke om igangværende myokardieiskæmi, uanset EKG- eller biomarkørfund, behandles på samme måde som dem med klar STEMI. Det gælder især patienter, der forbliver symptomatiske trods indledende medicinsk behandling, er hæmodynamisk ustabile eller udvikler vedvarende ventrikulære arytmier. Tilsvarende blev retningslinjerne fra European Society of Cardiology (ESC) i 2023 opdateret til at anbefale, at patienter med LBBB eller RBBB og tegn eller symptomer, der stærkt indikerer igangværende myokardieiskæmi, skal behandles som patienter med definitiv STEMI, uanset om grenblokken tidligere er dokumenteret (Byrne et al.).
Sgarbossa-kriterier til diagnosticering af akut STEMI i forbindelse med LBBB
Det er indlysende, hvorfor forskere har stået over for udfordringer med at etablere EKG-kriterier til diagnosticering af akut STEMI ved tilstedeværelse af venstre grenblok (LBBB). Blandt de mest nyttige og velvaliderede kriterier er dem, der er udviklet af Sgarbossa og kolleger (Neeland et al.). Disse kriterier, kendt som Sgarbossa-kriterierne, er opsummeret i figur 7. For en omfattende diskussion henvises til afsnittet LBBB og akut myokardieinfarkt, som giver detaljeret indsigt i disse kriterier og deres kliniske anvendelse.
STEMI uden ST-elevationer på EKG
Der er situationer, hvor akut transmural iskæmi ikke forårsager ST-elevationer på 12-afledningers EKG, og disse situationer er som følger:
- Transmural iskæmi placeret i den posterolaterale region af venstre ventrikel. Dette kaldes posterior eller posterolateral eller inferobasal STEMI. Det forårsager ST-sænkninger i afledningerne V1-V3 (lejlighedsvis V4); disse sænkninger er reciprokke ST-segment-sænkninger, der afspejler de posteriore ST-segment-hævninger. De supplerende EKG-afledninger V7, V8 og V9 skal forbindes for at afsløre ST-hævningerne.
- Højre ventrikelinfarkt (STEMI): Ingen afledning i et standard 12-afledningers EKG er tilstrækkelig til pålideligt at påvise højre ventrikelinfarkt. Lejlighedsvis kan der observeres ST-segmentforhøjelser i afledning V1 og, mindre almindeligt, V2. For nøjagtigt at identificere ST-segmentforhøjelser hos patienter med STEMI i højre ventrikel er det imidlertid vigtigt at bruge højresidige EKG-afledninger, især V3R og V4R.
Bemærk, at posterolateralt (posterior, inferobasalt) infarkt og højre ventrikelinfarkt også er blevet diskuteret tidligere.
Ikke-signifikante ST-elevationer
Transmural myokardieiskæmi kan lejlighedsvis producere tilstrækkelig ST-elevation til at opfylde kriterierne i én afledning, men ikke nå den krævede tærskel i den tilstødende, sammenhængende afledning. I sådanne tilfælde er de formelle kriterier for STEMI måske ikke opfyldt, men patienten kan stadig være ved at udvikle et STEMI. Det er afgørende at opretholde en høj mistanke om STEMI hos patienter med brystsmerter, selv om ST-forhøjelserne er under den diagnostiske tærskel. Den aterotrombotiske proces under STEMI er dynamisk, hvilket betyder, at trombens størrelse – og dermed graden af koronar obstruktion – kan svinge fra minut til minut. Det anbefales at udføre serielle EKG-optagelser med regelmæssige intervaller (f.eks. hvert 5. minut), hvis de indledende ST-elevationer ikke opfylder de diagnostiske kriterier. Denne tilgang øger sandsynligheden for at opfange dynamiske ændringer, der indikerer STEMI.
Hyperakutte T-bølger
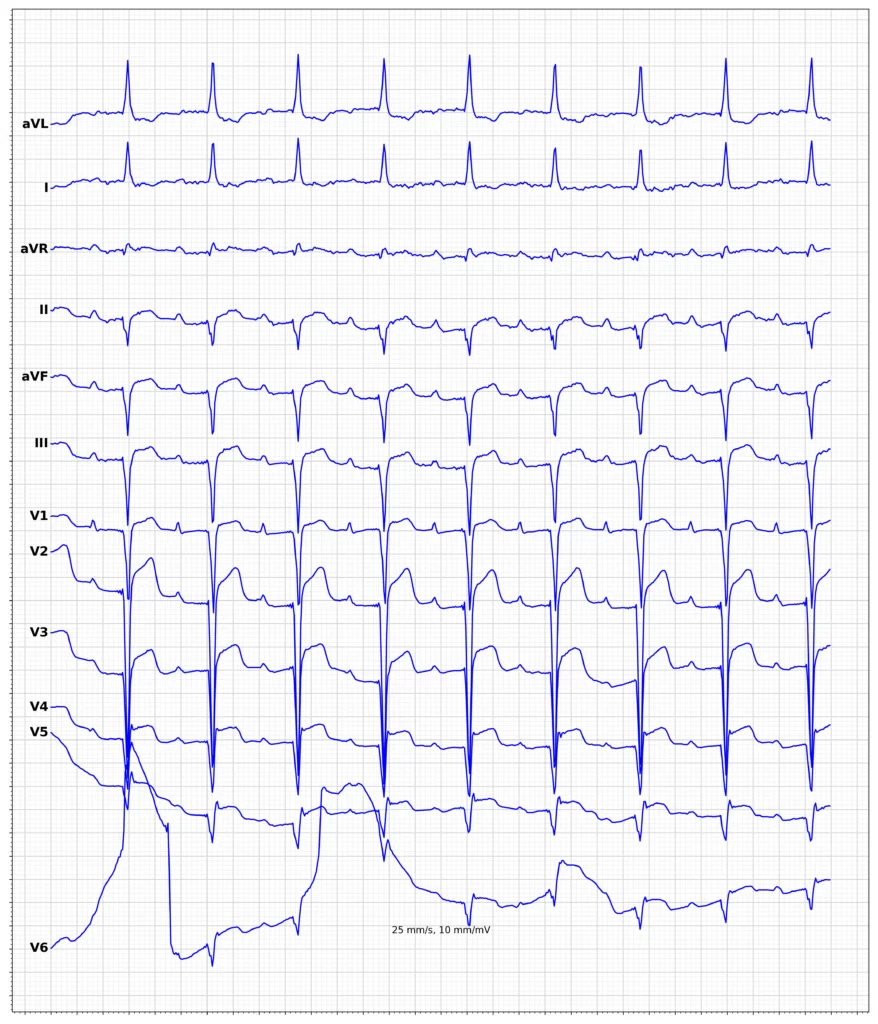
Store T-bølger kan forekomme under forskellige forhold, herunder hyperkaliæmi og tidlig repolarisering. Imidlertid kan transmural iskæmi producere hyperakutte T-bølger, som er tydeligt store, bredt baserede og symmetriske. Disse hyperakutte T-bølger opstår inden for få sekunder efter okklusion af kranspulsåren og er den tidligste EKG-manifestation af STEMI. De forsvinder typisk inden for få minutter og overgår til ST-elevationer, efterhånden som iskæmien skrider frem. Selvom hyperakutte T-bølger er forbigående, er de ikke sjældne og ses ofte hos STEMI-patienter med dynamiske EKG-ændringer (STEMI eksempel 9).

Normalisering af EKG-forandringer ved STEMI
Hos patienter med STEMI normaliseres ST-T-forandringerne inden for dage eller uger. QRS-forandringer er for det meste permanente, især Q-bølger. Behandling og reperfusionsbehandling kan ændre den hastighed, hvormed EKG’et normaliseres hos patienter med STEMI.
Risikostratificering i den akutte situation
Tidlig risikovurdering kan forbedre resultaterne hos patienter med akut STEMI. Der er udviklet flere validerede risikomodeller til at forenkle risikostratificeringen. Disse modeller omfatter typiske oplysninger om sygehistorie, EKG-fund, aktuelt træk (især hæmodynamisk status) og hjertetroponiner. De mest validerede risikomodeller er TIMI Score (Morrow et al.) og GRACE Score (Keith et al.). De varierer med hensyn til den type risiko, der estimeres (kortvarig, langvarig, myokardieinfarkt, død). TIMI-scoren er den enkleste at bruge, mens GRACE-scoren har vist sig at være den mest nøjagtige.
TIMI Risk Score-beregner til STEMI
Fortolkning af TIMI-score
| Punkt | dødelighed efter 30 dage |
|---|---|
| 0 | 0,8% |
| 1 | 1,6% |
| 2 | 2,2% |
| 3 | 4,4% |
| 4 | 7,3% |
| 5 | 12,4% |
| 6 | 16,1% |
| 7 | 23,4% |
| 8 | 26,8% |
| 9-14 | 35,9% |
Håndtering af patienter med STEMI
Okklusion af en koronararterie forårsager straks iskæmi i det myokardium, der forsynes af den ramte arterie og dens forgreninger. Myokardiet kan udholde iskæmi i ca. 30 minutter, før der opstår irreversibel celledød, hvilket resulterer i myokardieinfarkt. Som tidligere omtalt (Klassifikation af akut myokardieinfarkt) er STEMI forårsaget af en komplet koronar okklusion, hvilket fører til omfattende transmural iskæmi og en betydeligt forhøjet risiko for livstruende ventrikulære arytmier. Ventrikulær takykardi (VT) ved akut iskæmi er typisk polymorf, og risikoen for progression til ventrikelflimmer (VF) og død er høj. Risikoen er størst inden for den første tid efter symptomdebut. Langt størstedelen af alle dødsfald i den akutte fase skyldes ventrikulære arytmier, som kan udvikle sig til asystoli og i sidste ende hjertestop (Figur 8). Død som følge af dysfunktion i venstre ventrikel, der resulterer i kardiogent chok, er langt mindre almindeligt i den akutte fase.
Den præhospitale fase
På grund af risikoen for ventrikulære arytmier og det gradvise tab af myokardiet er hurtig vurdering og iværksættelse af behandling afgørende hos patienter med akut STEMI. Et væld af undersøgelser viser, at langt de fleste dødelige myokardieinfarkter opstår uden for hospitalet, oftest inden for den første tid. Derfor anbefaler amerikanske og europæiske retningslinjer, at patienter med brystsmerter skal bruge EMS (Emergency Medical Service) til transport til hospitalet. Ambulancepersonalet skal være uddannet i avanceret hjertelungeredning og tidlig behandling af akut STEMI.
Det præhospitale behandlingskæde indledes på alarmcentralen. Afsenderen bruger typisk standardiserede protokoller til at vurdere risikoen for akut STEMI, triagere patienter (fastsætte en afsendelsesprioritet), give instruktioner før ankomsten og koordinere ambulancen til stedet. EMS kan derefter straks starte en diagnostisk udredning, etablere intravenøse slanger, vurdere vitale funktioner og håndtere hæmodynamisk og elektrisk ustabilitet. Administration af aspirin, nitroglycerin, morfin og ilt er generelt sikkert i præhospitale omgivelser. Det er vigtigt, at ambulancepersonalet kan tage et 12-afledningers EKG, som kan sendes elektronisk til hospitalet til yderligere evaluering. I nogle tilfælde kan ambulancefolkene endda give reperfusionsbehandling (fibrinolyse) undervejs til hospitalet.
Undersøgelser har vist betydningen af præhospital forsinkelse hos patienter med akut STEMI. Hver times forsinkelse før hospitalet øger dødeligheden med 10 %. På samme måde øges risikoen for at udvikle hjertesvigt (på grund af akut STEMI) også med 10 % pr. gange behandlingsforsinkelse (Terkelsen et al.). Anerkendelse af det præhospitale potentiale kan derfor reducere forsinkelsen af interventioner og efterfølgende reducere morbiditet og mortalitet hos patienter med akut STEMI.
Som nævnt ovenfor kan ambulancepersonalet stille diagnosen STEMI ved hjælp af et 12-afledningers EKG. Selvom undersøgelser viser, at ambulancepersonalet er i stand til at diagnosticere STEMI, bør EKG-sporingen sendes til hospitalet til yderligere evaluering. Uden unødig forsinkelse bør patienten derefter transporteres til et hospital med faciliteter og ekspertise til at udføre perkutan koronar intervention (PCI).
Den akutte afdeling
Det første skridt i behandlingen af patienter med STEMI er hurtig erkendelse, da effekten af interventioner (antitrombotisk behandling, antiiskæmisk behandling og reperfusion) er størst, når de udføres tidligt. Diagnosen bekræftes med EKG (supplerende afledninger kan være nødvendige, som beskrevet ovenfor). Tilstedeværelsen af signifikante ST-elevationer hos patienter med brystsmerter (eller andre symptomer, der tyder på myokardieiskæmi) er tilstrækkelig til at diagnosticere STEMI. Alle indgreb (herunder reperfusion) kan udføres, før biomarkører (troponiner) er tilgængelige. Når diagnosen er bekræftet, skal patienten overvåges kontinuerligt (hjertefrekvens og -rytme, blodtryk, respiration, bevidsthed, symptomer, generel fremtoning). En defibrillator skal være klar, og der skal sikres venøs adgang. Det er altid klogt at foretage en hurtig vurdering af sandsynligheden for aortadissektion, før man giver medicin, der øger blødningsrisikoen.
For at skabe klarhed er STEMI et klinisk syndrom (defineret ved symptomer og EKG), og der kræves ikke biomarkører for at iværksætte interventioner. Derfor bør antiiskæmisk og antitrombotisk medicin gives med det samme, forudsat at der ikke er kontraindikationer. I nogle tilfælde (omtalt nedenfor) kan reperfusion også give uden forsinkelse.
Den kliniske undersøgelse skal omfatte vitale parametre (bevidsthed, hjertefrekvens og -rytme, iltmætning, blodtryk, respirationsfrekvens), tegn på hjertesvigt og lungeødem samt mislyde (mitralinsufficiens, ventrikelseptumdefekt). Der bør også foretages en hurtig vurdering af blødningsrisikoen (se nedenfor).
Patienter med klare symptomer på myokardieiskæmi forud for pludseligt hjertestop skal transporteres til kateteriseringslaboratoriet med det samme, hvis cirkulationen vender tilbage.
Alle NSAID (Non-Steroidal Anti-Inflammatory Drug) bør tilbageholdes i den akutte fase af STEMI, da disse lægemidler øger morbiditeten og mortaliteten, med aspirin som eneste undtagelse.
Evidensbaseret behandling af STEMI
Iltbehandling ved akut STEMI
Ilt bør gives, hvis iltmætningen er <90 %. Der er ingen dokumentation for, at ilt påvirker overlevelsen.
Der er ingen data, der understøtter nogen gavnlig effekt af iltbehandling hos patienter med normale iltniveauer målt med pulsoximetri. Randomiserede kontrollerede forsøg (hvor man sammenlignede ilt med rumluft) viste ikke nogen fordel ved at give ilt til patienter med normale iltniveauer (iltmætning >90 % ved pulsoximetri). Derfor anbefaler de nuværende retningslinjer supplerende ilt til patienter med iltmætning <90 %. Ilt er også passende til patienter med lungeødem, hjertesvigt og mekaniske komplikationer (frivægsruptur, ventrikulær septumdefekt, mitralprolaps) ved akut STEMI (Hofmann et al.).
Analgetika ved akut STEMI
Morfin
Morfinsulfat gives til alle patienter med akut STEMI (2 til 5 mg, kan gentages hvert 5. til 30. minut efter behov). Forsigtighed er påkrævet hos patienter med hypotension.
Smerte aktiverer det sympatiske nervesystem, hvilket resulterer i perifer vasokonstriktion, øget myokardial kontraktilitet (positiv inotrop effekt) og en forhøjet hjertefrekvens (positiv kronotrop effekt). Som følge heraf kan øget sympatisk aktivitet øge myokardiets arbejdsbyrde og potentielt forværre iskæmien. Dette kan være skadeligt for patienter med STEMI, hvilket gør tilstrækkelig smertebehandling til en kritisk del af behandlingen. Morfinsulfat er det foretrukne smertestillende middel. Morfin lindrer smerte og angst og fremmer venøs dilatation, hvilket mindsker hjertets forspænding. Sidstnævnte brev arbejdsbyrden på venstre ventrikel.
Den passende dosis morfin bestemmes af smertens intensitet, alder, body mass index (BMI) og kredsløbsstatus. Reducerede doser er nødvendige for patienter med hypotension, da morfin kan forårsage yderligere vasodilatation. Der anbefales en indledende intravenøs dosis på 2 til 5 mg, som kan gentages hvert 5. minut efter behov, op til i alt 30 mg. I tilfælde af overdosering med morfin kan naloxon (0,1 mg IV) administreres og gentages hvert 10. minut efter behov. Morfininduceret bradykardi kan forekomme og kan håndteres med atropin, startende med 0,5 mg IV, som kan gentages efter behov. Hvis smerterne fortsætter trods indgift af store mængder morfin, bør man overveje alternative diagnoser som f.eks. aortadissektion.
NSAID (ikke-steroide antiinflammatoriske lægemidler) og selektive cyclooxygenase II (COX-2)-hæmmere er kontraindiceret ved akut STEMI.
Bemærk, at nitrater og betablokkere også har en smertestillende effekt. Det er dog vigtigt, at administration af morfin ikke begrænser brugen af betablokkere. Mens morfin og betablokkere kan forstærke hinandens negative hæmodynamiske effekter, giver betablokkere antiarytmiske fordele i tilfælde af ventrikulære arytmier.
Nitrater (nitroglycerin) ved akut STEMI
Nitrater
Nitrater giver til langt de fleste patienter med STEMI. Det påvirker ikke prognosen, men lindrer symptomerne. Sublingual nitroglycerin (0,4 mg; kan gentages til gange med 5 minutters mellemrum) kan derfor gives til lindring af iskæmisk ubehag. Intravenøs nitroglycerin overvejes, hvis det iskæmiske ubehag ikke lindres. Nitroglycerin overvejes også til patienter med kongestiv hjerteinsufficiens samt til patienter med ukontrolleret hypertension.
Nitrater (nitroglycerin) producerer vasodilatation ved at afslappe den glatte muskulatur i arterier og vener. Vasodilatationen reducerer det venøse tilbageløb til hjertet, hvilket mindsker hjertets forspænding. Dette reducerer arbejdsbyrden på myokardiet og dermed myokardiets iltbehov. Nitrater lindrer både iskæmiske symptomer (brystsmerter) og lungeødem. Langt de fleste patienter bør tilbydes nitrater.
En dosis på 0,4 mg (sublingual eller tablet) giver og kan gentages 3 gange med 5 minutters mellemrum. Nitroglycerin-infusion bør overvejes, hvis effekten er utilstrækkelig (svær angina), eller hvis der er tegn på hjertesvigt. En infusion kan påbegyndes med 5 μg/min og optitreres hvert 5. minut til 10-20 μg/min. Dosis optitreres, indtil symptomerne er lindret, eller en maksimal dosis på 200-300 μg/min er nået.
Nitrater bør ikke administreres til patienter med hypotension, hvis der er mistanke om højre ventrikelinfarkt, alvorlig aortastenose, hypertrofisk obstruktiv kardiomyopati eller lungeemboli. Administrationen skal foregå med forsigtighed, hvis blodtrykket falder >30 mmHg fra baseline.
Betablokkere ved akut STEMI
Betablokkere
– Der er ingen evidens for, at rutinemæssig brug af betablokkere efter STEMI reducerer morbiditet eller mortalitet.
– Det er tydeligt, at betablokkere reducerer morbiditet og mortalitet hos patienter med akut MI, som udvikler hjertesvigt med reduceret ejektionsfraktion (HFrEF).
– AHA/ACC-retningslinjerne, der sidst blev opdateret i 2013, anbefalede generelt betablokkere efter akut STEMI på trods af manglende evidens.
– ESC-retningslinjerne fra 2023 siger, at intravenøse betablokkere, fortrinsvis metoprolol, bør overvejes på indlæggelsestidspunktet for patienter, der gennemgår primær PCI, forudsat at de ikke viser tegn på akut hjertesvigt, har et systolisk blodtryk (SBP) >120 mmHg og ikke har andre kontraindikationer (klasse IIa, evidensniveau A).
Evidens for betablokkere
Historisk set blev betablokkere brugt universelt i præ-reperfusionsæraen, før fibrinolyse og primær PCI blev udbredt, og de viste fordele ved at reducere infarktstørrelsen og forbedre overlevelsen (Hoedmaker et al.). Disse tidlige studier blev dog udført i en tid, hvor de fleste patienter havde omfattende myokardieinfarkter med svær dysfunktion i venstre ventrikel (Braunwald et al.). Det er velkendt, at betablokkere reducerer morbiditet og mortalitet hos patienter med hjertesvigt og nedsat ejektionsfraktion, uanset den underliggende ætiologi. På det seneste er der blevet sat spørgsmålstegn ved effektiviteten af betablokkere hos patienter med akut infarkt uden dysfunktion i venstre ventrikel. En metaanalyse (Bangalore et al.) fandt ingen fordele ved betablokkere i denne population. På trods af dette har retningslinjerne i vid udstrækning anbefalet brug af betablokkere, selv hos patienter uden dysfunktion i venstre ventrikel (O’Gara et al.; Byrne et al.). Det største studie, der direkte adresserer dette spørgsmål, REDUCE-AMI, undersøgte, om langvarig oral betablokkerbehandling hos patienter med akut MI og bevaret ejektionsfraktion i venstre ventrikel (≥50%) reducerede risikoen for død eller tilbagevendende MI sammenlignet med ingen betablokkerbehandling. REDUCE-AMI viste, at langtidsbehandling med betablokkere ikke sænkede risikoen for det sammensatte primære endepunkt sammenlignet med ingen brug af betablokkere (Yndigegn et al.).
Fysiologiske effekter af betablokkere
Betablokkere har negative inotrope og kronotrope effekter, der fører til nedsat hjertefrekvens (forlænget diastole), nedsat hjerteminutvolumen og lavere blodtryk. Disse effekter reducerer samlet set myokardiets arbejdsbyrde, iltforbrug og iltbehov. Forlængelsen af diastolen forbedrer også myokardieperfusionen, da koronar blodgennemstrømning primært sker under diastolen. Betablokkernes evne til at undertrykke ventrikulære arytmier menes at stamme fra deres anti-sympatiske virkninger.
Hvis det er nødvendigt, kan metoprolol indgives intravenøst i doser på 5 mg, gentaget op til tre gange med 5-10 minutters mellemrum, med kontinuerlig overvågning af hjertefrekvens og blodtryk under indgivelsen. Til oral administration kan metoprolol 25 mg give hver sjette tid og titreres til den maksimalt tolererede dosis, op til 200 mg dagligt. Det er vigtigt at bemærke, at evidensen for langvarig brug af betablokkere er begrænset til patienter med hjertesvigt og nedsat ejektionsfraktion.
Kontraindikationer for betablokkere
Patienter med akut hjertesvigt bør ikke få betablokkere i den akutte fase. Betablokkere bør dog startes tidligt, når hjertesvigtet er stabiliseret. Patienter med førstegrads AV-blok skal have foretaget endnu et EKG efter indgift af betablokkere, da AV-blokken kan udvikle sig til højere grader af AV-blok. Andengrads og tredjegrads AV-blok (uden pacemaker) er kontraindikationer. Patienter med KOL (kronisk obstruktiv lungesygdom) bør få beta-1-selektive midler (f.eks. bisoprolol).
Antitrombotisk behandling
Trombocythæmmende midler
Aspirin (ASA)
En oral startdosis af aspirin (160 mg til 320 mg) skal gives med det samme til alle patienter. Aspirin gives i præhospitale omgivelser og før primær PCI. Aspirin fortsættes på ubestemt tid (vedligeholdelsesdosis 75-80 mg dagligt).
Alle patienter skal straks have aspirin (oral startdosis 160 til 320 mg) og derefter fortsætte på ubestemt tid med en vedligeholdelsesdosis på 80 mg dagligt.
Tidlige studier viste, at aspirin har en bemærkelsesværdig effekt og reducerede 30-dages dødeligheden med 23 % (ISIS-1, ISIS-2). En startdosis på 160 til 320 mg er indiceret til alle patienter med akut STEMI. Patienter, som ikke kan synke, kan få 300 mg som stikpille eller 80 til 150 mg i.v. Alle patienter skal have en vedligeholdelsesdosis på 80 mg dagligt, som fortsættes på ubestemt tid. Overfølsomhed over for aspirin er sjælden; i sådanne tilfælde kan clopidogrel anvendes som et alternativ.
Justering af dosis
- Aspirin kræver ikke dosisjustering hos patienter med kronisk nyresygdom (CKD).
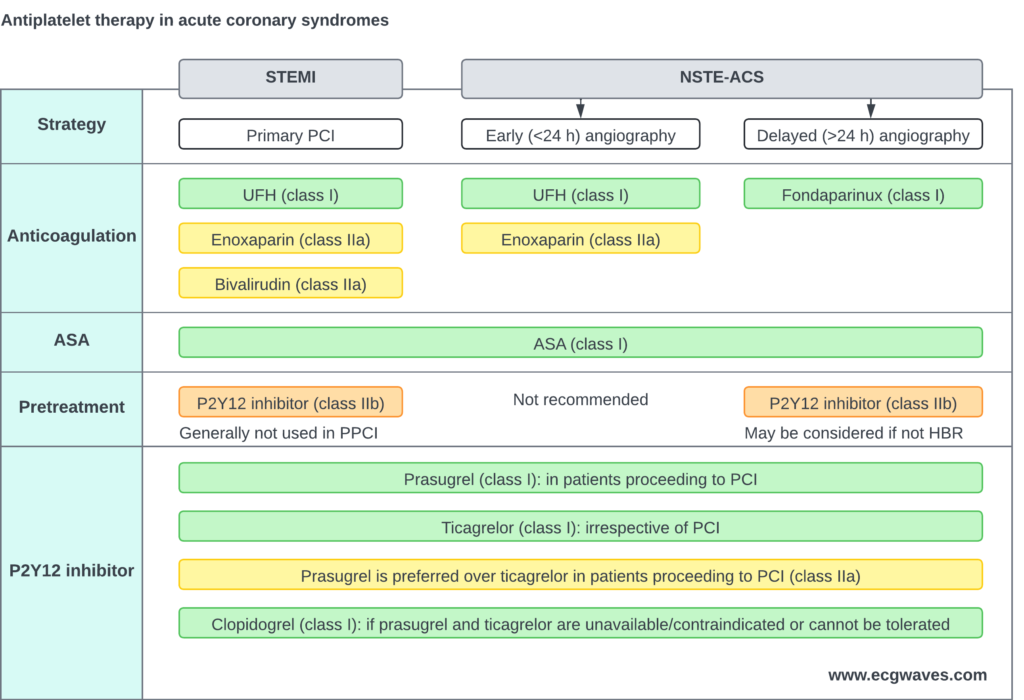
Dobbelt trombocythæmmende behandling (DAPT)
DAPT med P2Y12-receptorhæmmere
– Dobbelt trombocythæmmende behandling (DAPT) anbefales til alle patienter, der gennemgår PCI. Den optimale timing for påbegyndelse af DAPT – specifikt administration af P2Y12-receptorhæmmere i tillæg til aspirin – er dog stadig usikker.
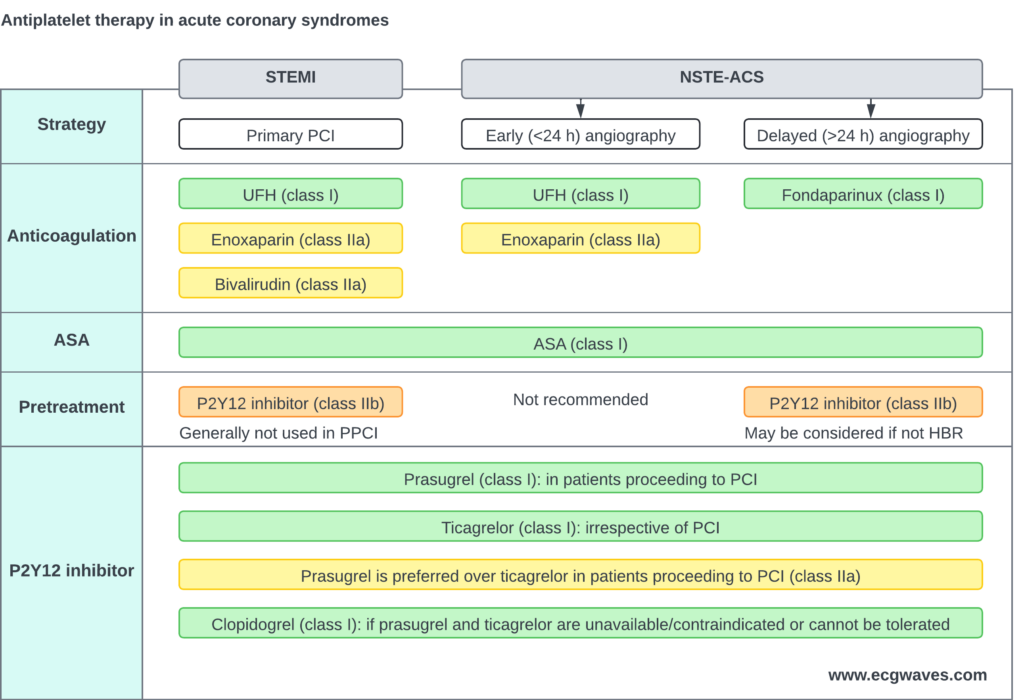
– Hos patienter med en arbejdsdiagnose af STEMI, der gennemgår primær PCI, kan forbehandling med en P2Y12-receptorhæmmer (administreret før angiografi) overvejes. Alternativt kan P2Y12-receptorhæmmeren give på PCI-tidspunktet, når koronaranatomien er kendt.
– Clopidogrel er den mindst effektive P2Y12-receptorhæmmer og bør kun anvendes, når prasugrel eller ticagrelor er kontraindiceret, ikke er tilgængelige, eller hvis der er en høj blødningsrisiko. Clopidogrel kan også være passende hos ældre patienter.
– Prasugrel bør foretrækkes frem for ticagrelor hos patienter, der gennemgår PCI. ISAR-REACT 5-studiet viste, at prasugrel er bedre end ticagrelor (Schupke et al.).
Den optimale trombocythæmmende behandling kræver kombineret brug af aspirin med en P2Y12-receptorhæmmer (ticagrelor, prasugrel eller clopidogrel), kaldet dobbelt trombocythæmmende behandling (DAPT). Der skal foretages en individuel vurdering af blødningsrisikoen, og DAPT bør undgås, hvis risikoen er høj. DAPT fortsættes i 12 måneder hos alle patienter, og indikationen er stærkere hos patienter, der gennemgår PCI med indsættelse af en stent (bare metal stent eller drug-eluting stent).
Forbehandling med en P2Y12-receptorhæmmer
Forbehandling med en P2Y12-hæmmer henviser til administration af en belastningsdosis af P2Y12-hæmmeren før evaluering af koronaranatomien, typisk i ambulancen, på akutafdelingen eller på koronarafdelingen (Niezgoda et al.). Formålet med denne tilgang er at opnå en hurtig hæmning af blodpladerne. Meget tyder dog på, at forbehandling ikke giver væsentlige kardiovaskulære fordele og kan øge risikoen for større blødninger. Derudover kan det komplicere akutte kirurgiske indgreb på grund af en forhøjet blødningsrisiko (Dawson et al.). De nuværende retningslinjer giver ikke klare anbefalinger om den optimale brug af forbehandling. I den nuværende praksis (2025) udsættes administrationen af en P2Y12-hæmmer ofte, indtil koronaranatomien er blevet vurderet, og der er truffet en beslutning om at fortsætte med PCI (hvilket kræver administration af P2Y12-hæmmere ) eller kirurgi (P2Y12-hæmmere tilbageholdes). Forbehandling anbefales dog, når en tidlig invasiv tilgang ikke er planlagt, forudsat at patienten har en lav risiko for blødning.
Clopidogrel
Tilføjelse af clopidogrel til aspirin vil yderligere reducere dødeligheden med 13%. En startdosis på 600 mg efterfulgt af en vedligeholdelsesdosis på 75 mg dagligt anbefales. Den ekstra stigning i blødningsrisikoen er mindre med clopidogrel sammenlignet med prasugrel og ticagrelor.
Clopidogrel kræver ikke dosisjustering hos patienter med kronisk nyresygdom (CKD).
Prasugrel
Prasugrel er et mere potent trombocythæmmende middel sammenlignet med clopidogrel. Derudover har det vist sig at give større reduktioner i kardiovaskulær dødelighed, ikke-dødeligt akut myokardieinfarkt og slagtilfælde (Wiviott et al.). Randomiserede kliniske forsøg viser, at prasugrel er særligt effektivt hos patienter med forreste STEMI. Det anbefalede doseringsregime er en startdosis på 60 mg efterfulgt af en vedligeholdelsesdosis på 10 mg dagligt. Prasugrel er kontraindiceret hos patienter med tidligere slagtilfælde, forbigående iskæmisk anfald (TIA) eller leversvigt. Desuden skal det bruges med forsigtighed til patienter over 75 år eller dem, der vejer mindre end 60 kg, på grund af en øget risiko for blødning i disse populationer.
Dosisjusteringer og kontraindikationer
- Hos patienter med en kropsvægt på <60 kg anbefales en vedligeholdelsesdosis på 5 mg én gang dagligt.
- Hos patienter i alderen ≥75 år bør der anvendes en vedligeholdelsesdosis på 5 mg én gang dagligt.
- Ingen specifik dosisjustering hos CKD-patienter.
- Tidligere slagtilfælde, TIA og leversvigt er kontraindikationer for prasugrel.
Ticagrelor
Ticagrelor (startdosis 180 mg, vedligeholdelsesdosis 90 mg til gange dagligt) er mere effektiv end clopidogrel og reducerer kardiovaskulær mortalitet, ikke-dødeligt akut myokardieinfarkt og slagtilfælde. Selvom PLATO-studiet viste, at ticagrelor forårsagede flere alvorlige blødninger sammenlignet med clopidogrel, var den samlede effekt gavnlig, og det blev konkluderet, at fordelene opvejede risiciene (Wallentin et al.).
Patienter rapporterer ofte om dyspnø og, mindre hyppigt, bradykardi i løbet af den første uge af ticagrelor-behandlingen. Disse bivirkninger er godartede og normalt forbigående. Ticagrelor er kontraindiceret hos patienter med tidligere hjerneblødning eller leversvigt (clopidogrel anbefales i stedet til disse patienter).
Ticagrelor kræver ikke dosisjustering hos patienter med kronisk nyresygdom (CKD).
Antikoagulantia ved akut STEMI
– Ufraktioneret heparin (UFH) er førstevalget af antikoagulantia og bør administreres til alle patienter med STEMI, der gennemgår primær PCI (klasse I-anbefaling).
– Alternative antikoagulantia (enoxaparin og bivalirudin) anvendes til patienter, der gennemgår primær PCI, når UFH ikke er tilgængelig.
Heparin med lav molekylvægt (enoxaparin) og ufraktioneret heparin (UFH)
Lavmolekylært heparin (enoxaparin) og ufraktioneret heparin (UFH) reducerer dødeligheden hos patienter med STEMI. UFH foretrækkes frem for enoxaparin. Belastningsdosis af UFH er 70-100 U/kg, givet som en bolus. Hvis patienten også får GP IIb/IIIa-antagonister, reduceres UFH til 50-60 U/kg.
Bivalirudin
Bivalirudin blev sammenlignet med en kombination af UHF og GP IIb/IIIa-antagonister i HORIZONS-AMI-forsøget. Bivalirudin forårsagede færre blødninger og resulterede i lavere dødelighed. Derfor foretrækkes bivalirudin frem for kombinationen af UFH og GP IIb/IIIa-antagonist hos patienter, der gennemgår primær PCI. Bivalirudin foretrækkes også til patienter med heparininduceret trombocytopeni (HIT) samt i tilfælde med høj blødningsrisiko.
Fondaparinux
Fondaparinux blev evalueret i OASIS-6-studiet, og der var ingen gavnlige effekter hos patienter, der gennemgik primær PCI. Tværtimod var fondaparinux forbundet med en øget risiko for stenttrombose.
Glykoprotein (GP) IIb/IIa-receptorantagonister
– Gp IIb/IIIa-antagonister kan overvejes under PCI, hvis proceduren ikke lykkes (langsomt eller intet flow), eller hvis angiografi viser massiv trombose eller trombosekomplikationer.
– Gp IIb/IIIa-antagonister kan ledsage ufraktioneret heparin (som derefter skal dosisreduceres), hvis der ikke er kontraindikationer.
– Gp IIb/IIIa-antagonister kan administreres under transport til højrisikopatienter, som henvises til primær PCI.
Disse midler (abciximab, tirofiban, eptifibatid, elinogrel) blokerer GP IIb/IIIa-receptoren, som er placeret på blodpladernes membran og forbinder blodpladerne med fibrinogen og von Willebrand-faktor. Denne klasse af lægemidler er faktisk de mest potente blodpladehæmmere, der findes. Tilføjelsen af disse midler giver dog kun få fordele, som synes at være forbeholdt visse undergrupper af patienter.
Glykoprotein IIb/IIIa-hæmmere anvendes oftest under perkutan koronar intervention (PCI), når der opstår komplikationer. De er især nyttige i følgende scenarier:
- Langsomt koronarflow (langsomt reflow) efter PCI
- Fravær af koronar flow (no-reflow) efter PCI
- Omfattende trombose
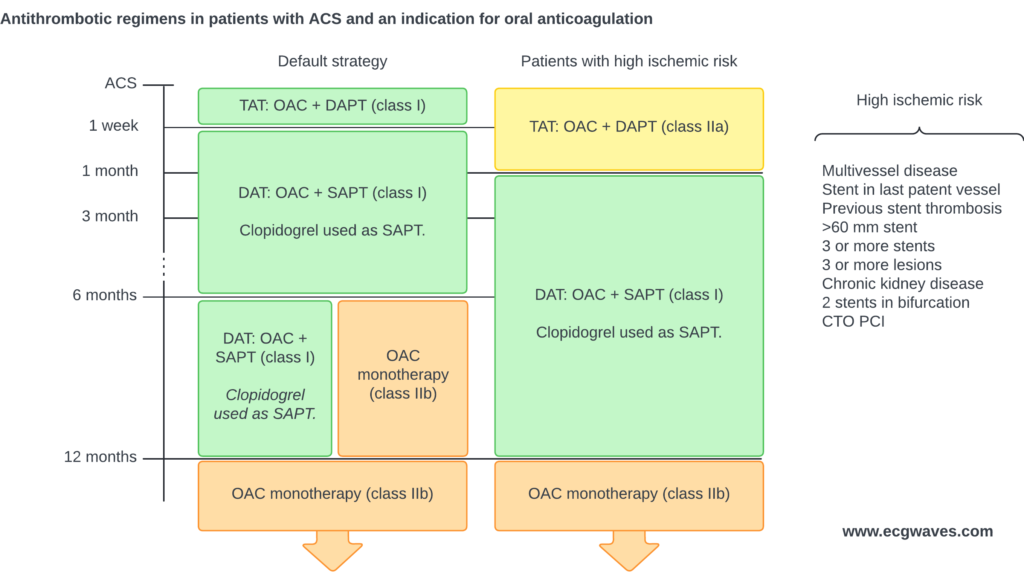
Langvarige antitrombotiske regimer hos patienter med STEMI
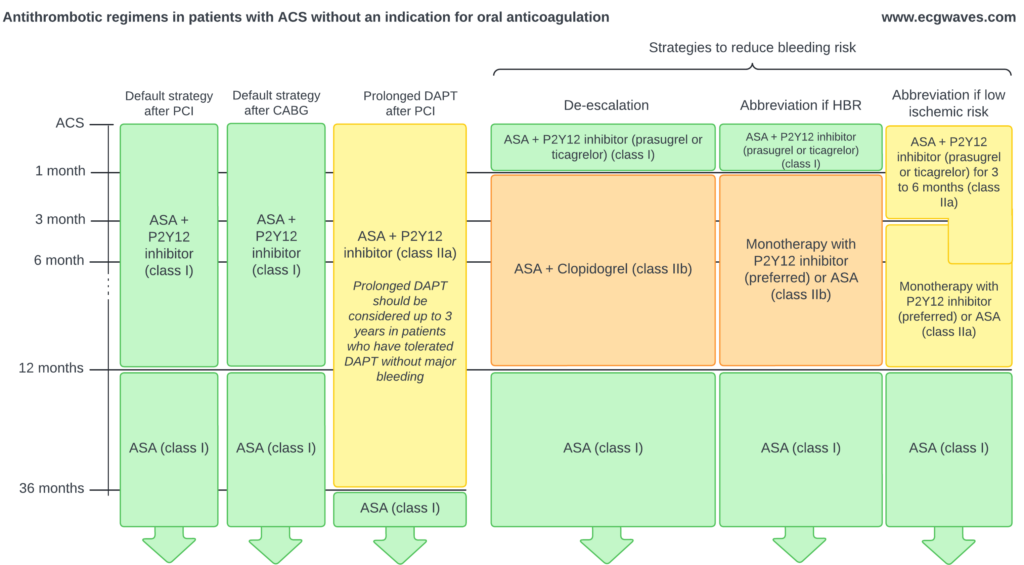
Figur 10 viser de antitrombotiske regimer hos patienter uden indikation for oral antikoagulation.
Patienter uden indikation fororal antikoagulation
Patienter med indikation for oralantikoagulation
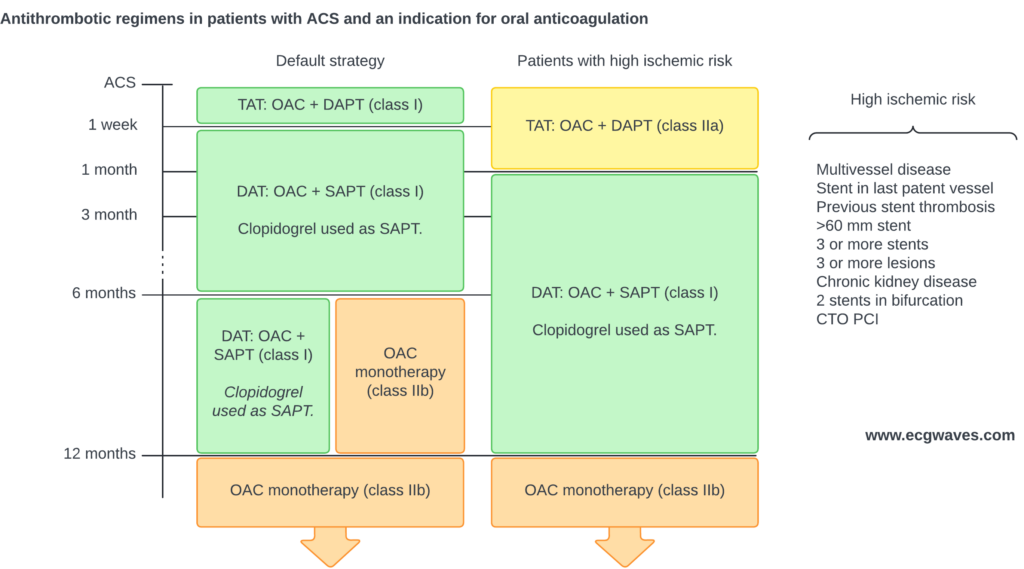
Figur 11 viser de antitrombotiske regimer hos patienter med indikation for oral antikoagulation (f.eks. patienter med atrieflimren i behandling med oral antikoagulantia).
Reperfusion ved akut STEMI: PCI og fibrinolyse
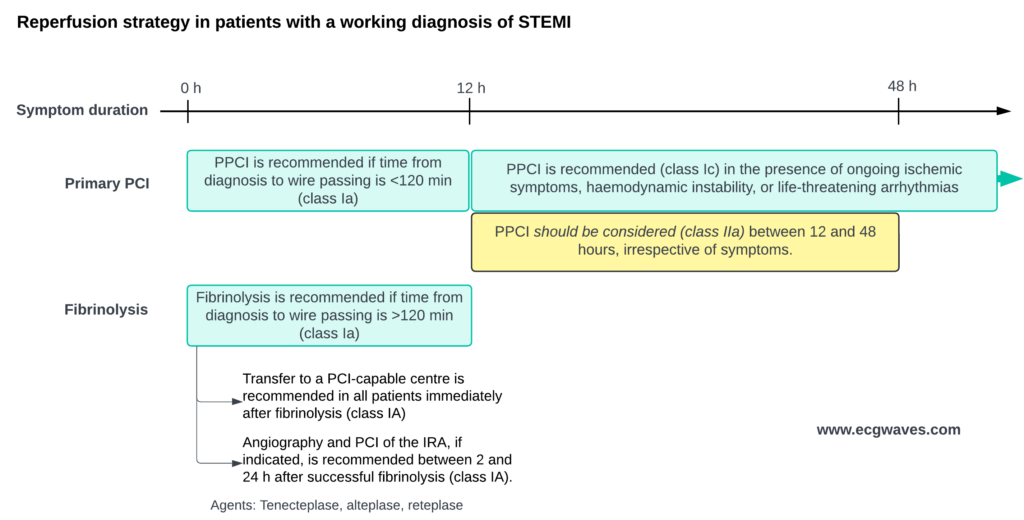
Reperfusion opnås ved hjælp af PCI eller intravenøs fibrinolyse. Vellykket reperfusion genopretter blodgennemstrømningen til det iskæmiske myokardium og standser infarktprocessen. PCI er bedre end fibrinolyse, hvis den kan udføres tidligt (inden for 120 minutter).
– Primær PCI er den anbefalede reperfusionsstrategi (klasse Ia) for STEMI-patienter, hvis tiden fra diagnose til trådpassage er <120 minutter.
– Hvis symptomerne varer ved i mere end 12 timer, anbefales primær PCI stadig (klasse Ic) hos patienter med vedvarende iskæmiske symptomer, hæmodynamisk ustabilitet eller livstruende arytmier.
– – Hos patienter, der indlægges mellem 12 og 48 timer efter symptomdebut, bør PCI overvejes (klasse IIa), selv om der ikke er symptomer Hos patienter, der indlægges mellem 12 og 48 timer efter symptomdebut, bør PCI overvejes (klasse IIa), selv om der ikke er symptomer.
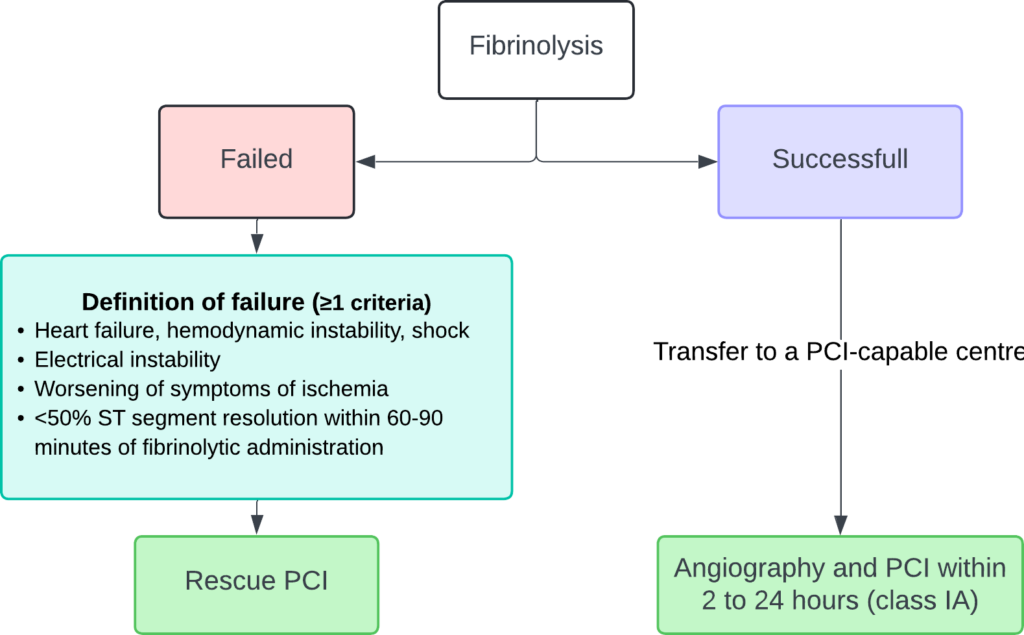
– Hvis tiden fra diagnose til PCI overstiger 120 minutter, anbefales fibrinolyse som den første reperfusionsstrategi (klasse Ia). Efter fibrinolyse anbefales overførsel til et PCI-kapabelt center for alle patienter, uanset det oprindelige resultat af fibrinolyse (klasse Ia). Angiografi og PCI af den infarktrelaterede arterie bør udføres mellem 2 og 24 timer efter vellykket fibrinolyse (klasse Ia).
Perkutan koronar intervention (PCI)
PCI er det mest effektive middel til at genoprette blodgennemstrømningen ved akut STEMI. Genoprettelse af koronar blodgennemstrømning er markant bedre med PCI sammenlignet med fibrinolyse (genindstrømningen er større, og risikoen for re-stenose er mindre). PCI er mindre afhængig af symptomernes varighed (fibrinolyse er afhængig af symptomernes varighed, fordi tromben reorganiseres gradvist og bliver mindre modtagelig for fibrinolytiske midler).
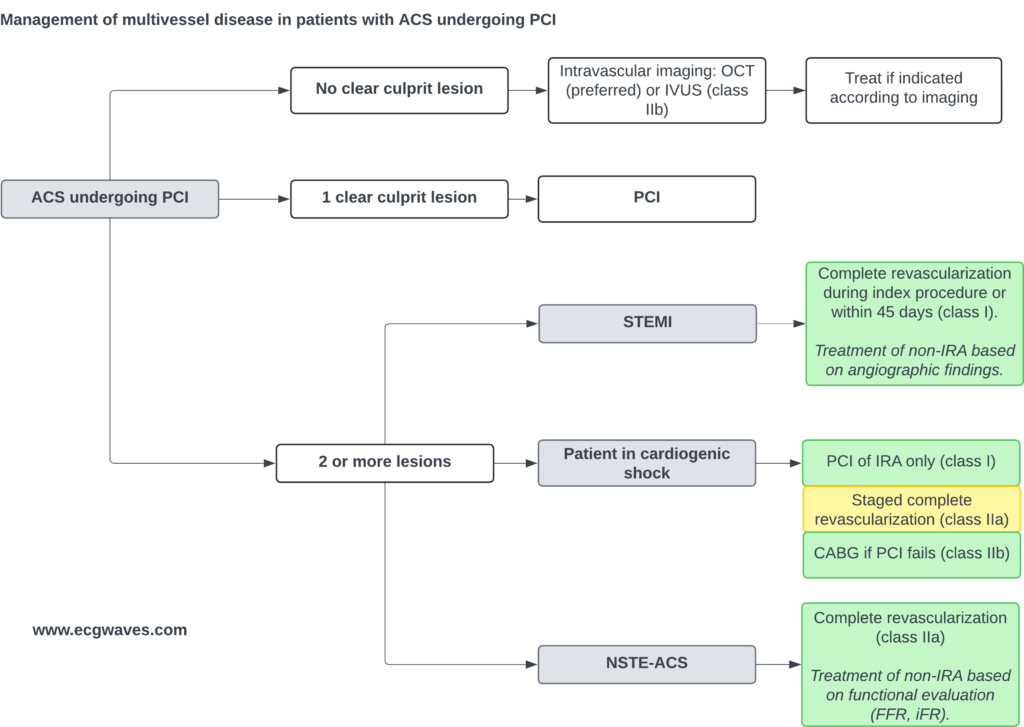
Hvis der ikke identificeres nogen klar skyldig læsion under angiografien, bør der anvendes intravaskulær billeddannelse til yderligere vurdering. Optisk kohærenstomografi (OCT) er den foretrukne modalitet, mens intravaskulær ultralyd (IVUS) anbefales som et klasse IIb-alternativ. Beslutninger om behandling bør baseres på billeddiagnostiske fund. Når en klar culprit-læsion er identificeret, bør den behandles med PCI.
Håndtering af multikar-sygdom hos patienter med STEMI, der gennemgår PCI
Komplet revaskularisering anbefales under indeksproceduren eller inden for 45 dage (klasse I-anbefaling). Behandling af læsioner i ikke-infarktrelaterede arterier (ikke-IRA) bør styres af angiografiske fund (billeddannelse og beregning af flowreserve er ikke nødvendig).
Patient i kardiogent chok
Den indledende behandling omfatter kun PCI af den infarktrelaterede arterie (IRA) (klasse I-anbefaling). Trinvis komplet revaskularisering kan udføres efterfølgende (klasse IIa anbefaling). Coronary artery bypass grafting (CABG) kan overvejes, hvis PCI mislykkes (klasse IIb-anbefaling).
Fibrinolyse
Fibrinolyse (tenecteplase, alteplase, reteplase) er meget effektiv til at opløse en trombe, hvis den giver tidligt (inden for 2 timer efter symptomdebut). Effekten af disse midler aftager gradvist på grund af en reorganisering af det trombotiske materiale. Hvis fibrinolyse administreres præhospitalt, kan det være lige så effektivt som PCI. Men fibrinolyse formår ofte ikke at etablere en åben blodgennemstrømning, og risikoen for reoklusion er betydelig. Desuden kan fibrinolyse forårsage alvorlige blødninger og endda dødsfald på grund af blødning.
Fibrinolyse betragtes som mislykket, hvis omfanget af ST-elevationer ikke er reduceret med 50 % inden for 60 minutter. I sådanne tilfælde bør PCI (rescue PCI) overvejes.
Absolutte kontraindikationer for fibrinolyse
- Tidligere hjerneblødning
- Slagtilfælde af ukendt type
- Iskæmisk slagtilfælde inden for de sidste 6 måneder
- Tumorer eller skader i centralnervesystemet
- Arteriovenøs misdannelse i centralnervesystemet
- Dissektion af aorta
- Nylig operation/traume (inden for 3 uger).
- Gastrointestinal blødning inden for 4 uger
- Koagulationsforstyrrelser
- Lumbalpunktur, leverbiopsi eller lignende procedurer inden for 24 timer.
Relative kontraindikationer for fibrinolyse
- Forbigående iskæmisk anfald (TIA) inden for 6 måneder.
- Igangværende oral antikoagulationsbehandling
- Graviditet eller 1 uge post partum
- Refraktær hypertension (systolisk blodtryk > 180 mmHg og/eller diastolisk blodtryk > 110 mmHg).
- Alvorlig leversygdom
- Infektiøs endokarditis
- Aktivt mavesår
- Langvarig eller traumatisk genoplivning
Koronararterie-bypass-transplantation (CABG)
CABG har en begrænset rolle i den akutte fase af STEMI. CABG bør dog overvejes, hvis (1) PCI mislykkes, (2) hvis koronaranatomien ikke er egnet til PCI, (3) hvis der er mekaniske komplikationer (f.eks. fri væg-ruptur) eller (4) kardiogent shock.
Referencer
1. Ducas, J., et al. “Outcomes of a Pre-Hospital Diagnosis and Catheter Laboratory Activation Program for ST Elevation Myocardial Infarction” Journal of the American College of Cardiology, vol. 53, no. 4, 2009, s. 246-252.
2. Mencl, F., et al. “EMS Provider and Physician Interpretation of Electrocardiograms in ST-Elevation Myocardial Infarction” Prehospital Emergency Care, vol. 16, no. 3, 2012, s. 378-382.
3. Sgarbossa, E. B., et al. “Elektrokardiografisk diagnose af udviklende akut myokardieinfarkt ved tilstedeværelse af venstre grenblok” (Elektrokardiografisk diagnose af udviklende akut myokardieinfarkt ved tilstedeværelse af venstre grenblok) The New England Journal of Medicine, vol. 334, nr. 8, 1996, s. 481-487.
4. Smith, S. W., et al. “Diagnosis of ST-Elevation Myocardial Infarction in the Presence of Left Bundle Branch Block with the ST-Elevation to S-Wave Ratio in a Modified Sgarbossa Rule” Annals of Emergency Medicine, vol. 60, nr. 6, 2012, s. 766-776.
5. Hoedemaker, G., et al. “Reduktion af myokardieinfarktets størrelse ved tidlig behandling med beta-adrenerg blokade.” The New England Journal of Medicine, vol. 301, nr. 7, 1979, s. 337-342.
6. Bangalore, S., et al. “Brug af β-blokkere og kliniske resultater hos stabile ambulante patienter med og uden koronararteriesygdom.” JAMA, vol. 308, nr. 13, 2012, s. 1340-1349.
7. O’Gara, P. T., et al. “2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction: Executive Summary.” Journal of the American College of Cardiology, vol. 61, nr. 4, 2013, s. 485-510.
8. Byrne, R. A., et al. “2018 ESC/EACTS Guidelines on Myocardial Revascularization.” European Heart Journal, vol. 39, nr. 2, 2018, s. 87-165.
9. Yndigegn, T., et al. “Efficacy of Long-Term β-Blocker Therapy for Secondary Prevention Following Myocardial Infarction in the Era of Percutaneous Coronary Intervention: A Meta-Analysis.” European Heart Journal, vol. 38, nr. 2, 2017, s. 103-112.
10. Schüpke, S., et al. “Ticagrelor or Prasugrel in Patients with Acute Coronary Syndromes.” The New England Journal of Medicine, vol. 381, nr. 16, 2019, s. 1524-1534.
11. Wiviott, S. D., et al. “Prasugrel versus Clopidogrel in Patients with Acute Coronary Syndromes.” The New England Journal of Medicine, vol. 357, nr. 20, 2007, s. 2001-2015.
12. Niezgoda, P., et al. “Præhospital administration af P2Y12-receptorhæmmere ved myokardieinfarkt med ST-segmentforhøjelse: A Meta-Analysis.” Journal of Thrombosis and Thrombolysis, vol. 44, no. 4, 2017, s. 489-498.
13. Dawson, L. P., et al. “Pre-Treatment with P2Y12 Inhibitors in ST-Elevation Myocardial Infarction: A Systematic Review and Meta-Analysis.” Heart, vol. 106, nr. 1, 2020, s. 20-26.
14. Morrow, D. A., Antman, E. M., Charlesworth, A., Cairns, R., Murphy, S. A., de Lemos, J. A., Giugliano, R. P., McCabe, C. H. & Braunwald, E. (2000). TIMI-risikoscore for myokardieinfarkt med ST-elevation: En praktisk, klinisk score ved sengen til risikovurdering ved præsentation: En delundersøgelse af intravenøs nPA til behandling af myokardieinfarkt tidligt i II-forsøget. Cirkulation, 102 (17), 2031-2037.
15. Gulati, M., Levy, P. D., Mukherjee, D., Amsterdam, E., Bhatt, D. L., Birtcher, K. K., Blankstein, R., Boyd, J., Bullock-Palmer, R. P., Conejo, T., Diercks, D. B., Gentile, F., Greenwood, J. P., Hess, E. P., Hollenberg, S. M., Jaber, W. A., Jneid, H., Joglar, J. A., Morrow, D. A., O’Connor, R. E., Ross, M. A., & Shaw, L. J. (2021). 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, 144 (22), e368-e454.
16. Granger, C. B., Goldberg, R. J., Dabbous, O., Pieper, K. S., Eagle, K. A., Cannon, C. P., Van de Werf, F., Avezum, A., Goodman, S. G., Flather, M. D., & Fox, K. A. A. (2003). Prædiktorer for hospitalsdødelighed i Global Registry of Acute Coronary Events. Archives of Internal Medicine, 163 (19), 2345-2353.
17. Fox, K. A. A., Dabbous, O. H., Goldberg, R. J., Pieper, K. S., Eagle, K. A., Van de Werf, F., Avezum, A., Goodman, S. G., Flather, M. D., Anderson, F. A., & Granger, C. B. (2006). Forudsigelse af risiko for død og myokardieinfarkt i de seks måneder efter præsentation med akut koronarsyndrom: prospektivt multinationalt observationsstudie (GRACE). BMJ, 333 (7578), 1091.
18. Eagle, K. A., Lim, M. J., Dabbous, O. H., Pieper, K. S., Goldberg, R. J., Van de Werf, F., Goodman, S. G., Granger, C. B., Steg, P. G., Gore, J. M., Budaj, A., Avezum, A., Flather, M. D., & Fox, K. A. A. (2004). En valideret forudsigelsesmodel for alle tidligere for akut koronarsyndrom: estimering af risikoen for død 6 måneder efter udskrivelsen i et internationalt register. JAMA, 291 (22), 2727-2733.
19. Thygesen, K., Alpert, J. S., Jaffe, A. S., Chaitman, B. R., Bax, J. J., Morrow, D. A., & White, H. D. (2018). Fjerde universelle definition af myokardieinfarkt (2018). Circulation, 138 (20), e618-e651.
20. Reed, G. W., Rossi, J. E., & Cannon, C. P. (2017). Akut myokardieinfarkt. The Lancet, 389 (10065), 197-210.
21. Anderson, J. L., & Morrow, D. A. (2017). Akut myokardieinfarkt. The New England Journal of Medicine, 376 (21), 2053-2064.