Forløbet fra pludseligt hjertestop (SCA) til død følger en patofysiologisk proces, der påvirker interventionernes effektivitet. Talrige undersøgelser viser, at de tilgængelige interventioner er tidsfølsomme, og for at maksimere sandsynligheden for at genoprette den spontane cirkulation bør interventionerne tilpasses den aktuelle fase. De nuværende retningslinjer tager dog ikke højde for dette faktum (ud over anbefalingen om at defibrillere med det samme, hvis man er vidne til et hjertestop, og rytmen er stødbar). Det skyldes, at der ikke er nogen måde at afgøre, hvilken fase patienten befinder sig i. De tre faser efter et pludseligt hjertestop blev beskrevet af Weisfeldt og Becker (2002). På baggrund af fysiologi, observationsstudier og eksperimentelle studier beskrev de disse faser, som kræver forskellige behandlingsstrategier for at maksimere overlevelsen (tabel 1).
| Fase | Periode | Optimal behandling |
|---|---|---|
| Elektrisk fase | 0 til 4 minutter | Defibrillering |
| Cirkulatorisk fase | 4 til 10 minutter | Kompressioner og ventilation, efterfulgt af defibrillering |
| Metabolisk fase | >10 minutter | Ukendt |
Eksistensen af disse faser understøttes af en lang række eksperimentelle og kliniske undersøgelser. Den elektriske fase og kredsløbsfasen forklares med cellulære ændringer i myokardiet. Den sidste fase er multifaktoriel og forårsaget af global iskæmi, acidose, inflammation, hypoxi og reperfusionsskade.
Myokardiets iltbehov
Myokardiet kan kun fungere under aerobe forhold (der kræves ilt til ATP-syntese [ATP er den primære energikilde i alle celler]). Hjertet bruger ca. 30 kg ATP om dagen (Neubauer et al.), hvilket er ca. 100 gange dets vægt. Det er muligt, fordi mitokondrierne optager næsten 30 % af myokardiecellernes volumen, hvilket gør det muligt at generere så store mængder ATP (Page et al.). Mitokondrietætheden giver mulighed for fuldstændig genopfyldning af ATP inden for 10 sekunder (Fell et al., Houtkooper et al.). Størstedelen af den producerede ATP bruges som brændstof til det kontraktile maskineri og til at opretholde ionkanalernes funktion.
Neumar et al. undersøgte, hvordan ATP-koncentrationen falder under ventrikelflimmer (VF). Dette blev gjort ved at tage serielle myokardiebiopsier efter at have induceret VF. Som det fremgår af figur 1, falder ATP-koncentrationen hurtigt. Efter 5 minutters VF var ca. 50 % af ATP’en tilbage.

Efterhånden som ATP-koncentrationen falder, ophører kritiske cellefunktioner. Membranpotentiale, aktionspotentiale, excitabilitet og kontraktil funktion er alle kompromitteret af ATP-depletion. Myokardienekrose (infarkt) begynder inden for 20 minutter efter kredsløbskollaps.
Den elektriske fase: Defibrillering
Det er sandsynligt, at størstedelen af hjertestop udløses af ventrikulær takykardi (VT) og ventrikulær fibrillation (VF). Defibrillering er ekstremt effektiv i løbet af de første par minutter af disse arytmier. Det fremgår af randomiserede forsøg og observationsstudier, der undersøger effekten af ICD (implanterbar kardioverterdefibrillator). En ICD er programmeret til at opdage VF/VT og defibrillere inden for 10-20 sekunder. Undersøgelser viser, at det lykkes ICD’er at afslutte VF/VT i 98 % af tilfældene (Zipes et al, Volosin et al). På samme måde kan VF/VT opdages og defibrilleres med det samme hos personer, der er indlagt på hospitalet, når de får hjertestop. Overlevelsen er omkring 70 %, når defibrillering udføres inden for 3 minutter efter kollapset (Hessulf et al.). Ved hjertestop uden for hospital (OHCA) er forsinkelsen fra kollaps til defibrillering betydeligt længere. Mediantiden til ambulancens ankomst er 10 til 15 minutter i Europa og Nordamerika, hvilket resulterer i en overlevelsesrate på ca. 30 %, hvis rytmen er stødbar ved ambulancens ankomst (Rawshani et al.).
| Forsinkelse fra VT/VF-debut til defibrillering | Bevis | Succesrate for defibrillering |
|---|---|---|
| <30 sekunder | ICD-forsøg | 98% |
| 3 minutter | Observationsstudier | 70% |
| <10-15 minutter | Observationsstudier | 20-30% |
For hvert minut, der går, falder sandsynligheden for en vellykket defibrillering, og risikoen for, at VF degenererer til asystoli, stiger. Figur 2 viser, hvordan overlevelsesraten falder fra 42 % til 29 % ved forsøg på defibrillering efter 5 minutter, når HLR påbegyndes efter henholdsvis 1 og 5 minutter (hjertestop med VF uden for hospital; Valenzula et al).
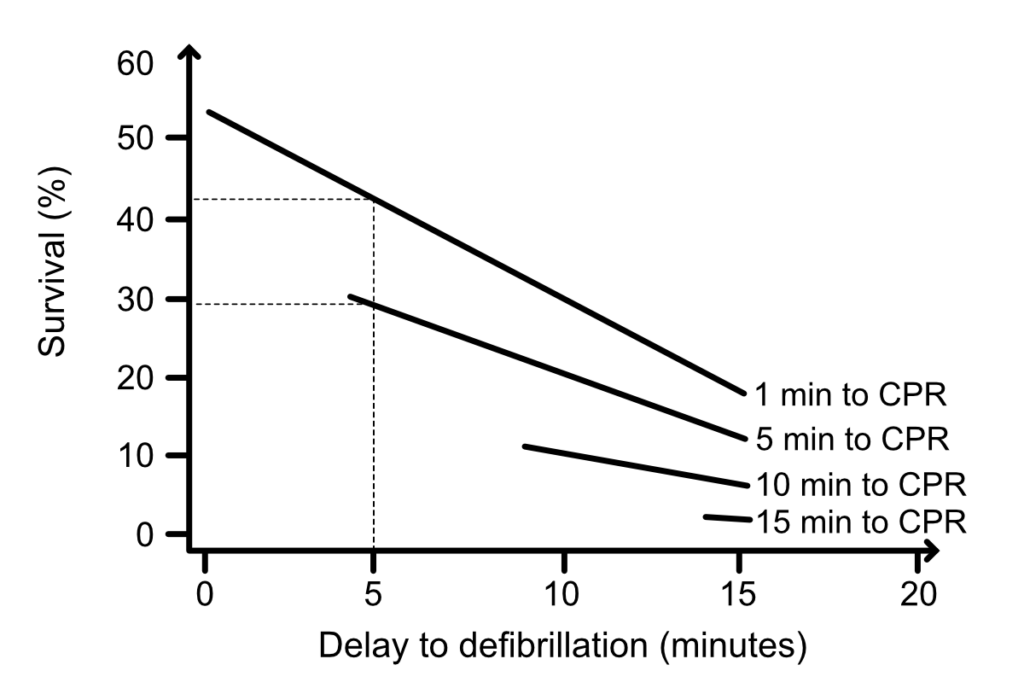
Der er ingen tvivl om, at effekten af defibrillering er meget høj i løbet af de første par minutter af VF. I denne periode (0-4 minutter) er kompressioner formentlig af ringe eller ingen nytte (Niemann et al.). Derfor er et elektrisk stød den mest hensigtsmæssige indledende intervention i den elektriske fase.
Den cirkulatoriske fase: Kompression og ventilation
I 1943 viste Gurvich et al., at sandsynligheden for at defibrillere VF med succes efter flere minutter steg, hvis defibrilleringen blev indledt med brystkompressioner. Som det fremgår af figur 2, er defibrillering mindre effektiv, jo længere tid der går, før kompressionerne påbegyndes. Cirkulationsfasen starter ca. efter 4 minutter, og i denne fase er defibrillering meget mindre effektiv. Kompressioner er afgørende for myokardieperfusionen, som er nødvendig for at gøre myokardiet modtageligt for defibrillering. Sandsynligheden for at defibrillere VF med succes øges, hvis kompressioner går forud for defibrillering i denne fase. Dette er blevet påvist i flere dyreforsøg:
- Yakaitis et al. viste, at defibrillering var den mest kritiske første intervention, hvis den blev udført inden for 3 minutter efter kollapset. Efter 5 minutters VF lykkedes defibrillering kun i 30 % af tilfældene sammenlignet med 70 %, når kompressioner gik forud for defibrillering.
- Niemann et al. viste, at hvis VF fortsatte i 7 minutter, var defibrillering 3 gange mere effektiv, hvis den blev forudgået af kompressioner.
- Menegazzi et al. viste, at hvis VF fortsatte i 8 minutter, var defibrillering 3 gange mere effektiv, hvis den blev forudgået af kompressioner og antiarytmika.
- Garcia et al. viste, at defibrillering var ineffektiv, hvis VF fortsatte i 6 minutter.
Flere dyreforsøg viser således, at jo længere tid VF varer, jo mindre er sandsynligheden for en vellykket defibrillering. Dette gælder helt sikkert også for mennesker. Heldigvis kan det modvirkes ved at udføre kompressioner og ventilation. Kompressionerne er afgørende for at skabe det koronare perfusionstryk (CPP), der er nødvendigt for at normalisere myokardiecellernes elektriske potentiale. Efter nogle få minutter bliver myokardiet faktisk så følsomt over for afbrydelser i perfusionen, at den tid, det tager for defibrillatoren at oplade, øger dødeligheden. Yu et al. demonstrerede dette ved bevidst at forsinke defibrillering med 3, 10, 15 eller 20 sekunder (pause efter kompressioner); alle defibrilleringer lykkedes, hvis afbrydelsen var 3 sekunder lang, men ingen var vellykkede, hvis afbrydelsen var 15 sekunder eller længere. Efter en pause i kompressionerne tager det ca. 15 sekunder med kompressioner at genopbygge det koronare perfusionstryk.
Da Cobb et al. undersøgte effekten af at udføre kompressioner i 90 sekunder før defibrillering ved hjertestop uden for hospitalet, så man en 42 % højere sandsynlighed for overlevelse (tilfælde med VF, hvor EMS-reaktionstiden var 4 minutter eller længere). En norsk undersøgelse med 200 hjertestop uden for hospital viste ligeledes, at 3 minutters HLR før defibrillering øgede sandsynligheden for ROSC med 2 gange (når EMS-responstiden var længere end 5 minutter; Wik et al).
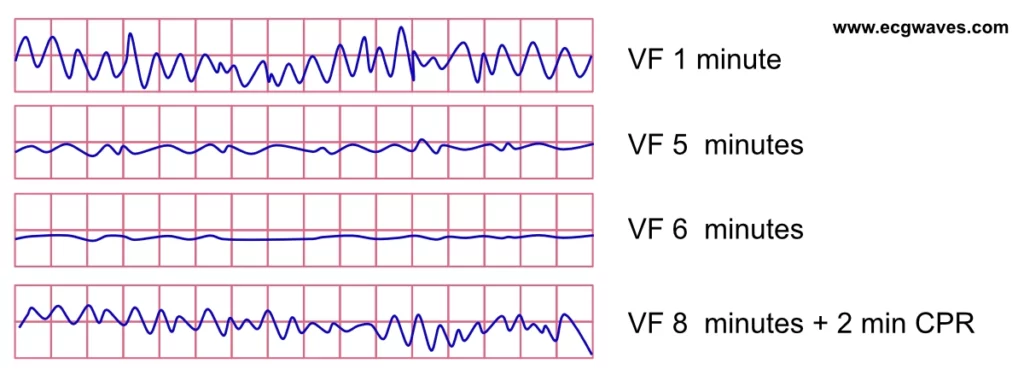
EKG’et afspejler den patofysiologiske proces, der gør defibrillering ineffektiv efter flere minutters ventrikelflimmer. Parallelt med reduktionen af ATP-koncentrationen i myokardiet falder amplituden af VF-bølgeformen. EKG’et viser en gradvis overgang fra grov VF til fin VF. Fin VF overgår i sidste ende til asystoli og død.
Den metaboliske fase
De fleste dødsfald sker i den metaboliske fase, som begynder efter ca. 10 minutter. Biologisk død (hjernedød) indtræffer dog efter 6-8 minutters totalt kredsløbsstop. Personer, der overlever hjertestop med længere varighed, har særlige omstændigheder, der forlænger tiden til biologisk død (f.eks. perioder med ventrikulær takykardi, der genererer hjertets output, ung alder, utilsigtet hypotermi osv.) Hvis hjerte-lunge-redning påbegyndes i den metaboliske fase, er kompressioner og defibrillering normalt ikke tilstrækkeligt til at redde personen. Det er uklart, hvilken behandling der er optimal i denne fase.
Den metaboliske fase er kendetegnet ved omfattende cerebral celledød og truende myokardienekrose. Myokardiets ATP-niveau er så lavt, at den elektriske aktivitet er ophørt (der opstår asystoli). Det resterende væv har udviklet iskæmi med efterfølgende lokal og global acidose. Effektive kompressioner kan derefter resultere i reperfusionsskader, der forværrer vævsskaden. Der er data, der tyder på, at reperfusion i myokardiet fremskynder myokardienekrose (Vanden Hoek et al.). Derudover er der udprægede elektrolytforstyrrelser, som komplicerer muligheden for at opretholde ROSC.
I den metaboliske fase udvikles hjerneskade og myokardieinfarkt både ved iskæmi (som forårsager celledød ved ophør af kritiske cellefunktioner) og toksiske virkninger af reperfusion (fremkaldt af HLR). Reperfusionsskader opstår, når ilttransmission til vævet resulterer i produktion af reaktive iltforbindelser (ROS). Reperfusionsskader opstår kun, hvis ilttilførslen varer for længe; der er en ukendt tidsgrænse for, hvornår ilttilførslen fører til vævsskade.
Referencer
Kaustubha D. Patil, Henry R. Halperin, Lance B. Becker. Genoplivning og reperfusion ved hjertestop. Circulation Research (2015).
Neubauer S. Det svigtende hjerte – en motor uden brændstof. New England Journal of Medicine. 2007;356:1140-1151
Fell DA, Sauro HM. Analyse af metabolisk kontrol. Virkningerne af høje enzymkoncentrationer. European Journal of Biochemistry. 1990;192:183-187
Houtkooper RH, Canto C, Wanders RJ, Auwerx J. Nad’s hemmelige liv: En gammel metabolit, der kontrollerer nye metaboliske signalveje. Endocrine Reviews. 2010;31:194-223
Gurvich NL, Yuniev GS. Genoprettelse af hjerterytmen under fibrillation ved hjælp af en kondensatorudladning. Am Rev Sov Med 1947;4:252-6.
Vanden Hoek TL, Shao Z, Li C, Zak R, Schumacker PT, Becker LB. Reperfusionsskade i hjertemyocytter efter simuleret iskæmi. Am J Physiol. 1996;270: H1334-H1341. 30.
Vanden Hoek TL, Qin Y, Wojcik K, et al. Reperfusion, ikke simuleret iskæmi, igangsætter intrinsisk apoptoseskade i kyllingekardiomyocytter. Am J Physiol Heart Circ Physiol.
Yakaitis RW, Ewy GA, Otto CW, Taren DL, Moon TE. Indflydelse af tid og terapi på ventrikulær defibrillering hos hunde. Crit Care Med. 1980;8:157-163.
Menegazzi JJ, Davis EA, Yealy DM, et al. An experimental algorithm versus standard advanced cardiac life support in a swine model of out-of-hospital cardiac arrest. Ann Emerg Med. 1993;22:235-239. 23.
Menegazzi JJ, Seaberg DC, Yealy DM, Davis EA, MacLeod BA. Kombineret farmakoterapi med forsinket modstød vs. standard avanceret hjertestøtte efter langvarig ventrikelflimmer. Prehosp Emerg Care. 2000;4:31-37.
Niemann JT, Cairns CB, Sharma J, Lewis RJ. Behandling af langvarig ventrikelflimmer. Circulation. 1992;85:281-287. 20.
Niemann JT, Cruz B, Garner D, Lewis RJ. Umiddelbart modstød versus hjerte-lunge-redning før modstød i en 5-minutters svinemodel af ventrikelflimmer-stop. Ann Emerg Med. 2000;36:543-546.
Garcia LA, Allan JJ, Kerber RE. Interaktioner mellem HLR og defibrilleringskurver. Resuscitation. 2000;47:301-305.
Page E, McCallister LP. Kvantitativ elektronmikroskopisk beskrivelse af hjertemuskelceller. Anvendelse på normale, hypertrofierede og thyroxin-stimulerede hjerter. Am J Cardiol. 1973;31:172-181.
